تانيوم هو عنصر كيميائي في الجدول الدوري ورمزه Ti ورقمه الذري 22. فلز انتقالي خفيف الوزن، قوي، ذو لمعان ومقاوم للصدأ (بما فيه ماء البحر والكلور)، ولونه معدني أبيض فضي.
ويستخدم التيتانيوم في السبائك القوية خفيفة الوزن (وخصوصاً مع الحديد والألومنيوم) وأكثر مركباته شيوعاً هي ثاني أكسيد التيتانيوم، والذي يستعمل في الصبغات البيضاء. ومن استخدامات تلك الصبغات البيضاء: سائل تصحيح الطباعة الأبيض Correction fluid والبويات البيضاء. ويستخدم كذلك في معجون الأسنان، علامات الطريق البيضاء، وفي الألعاب النارية البيضاء اللون
| تيتانيوم، 22، Ti | ||||||||||||||||||||||||||||||||||||||||
| فلز انتقالي | ||||||||||||||||||||||||||||||||||||||||
| 4، 4، d | ||||||||||||||||||||||||||||||||||||||||
| 47.867غ·مول−1 | ||||||||||||||||||||||||||||||||||||||||
| Ar]; 3d2 4s2] | ||||||||||||||||||||||||||||||||||||||||
| 2, 8, 10, 2 (صورة) | ||||||||||||||||||||||||||||||||||||||||
| صلب | ||||||||||||||||||||||||||||||||||||||||
| 4.506 غ·سم−3 | ||||||||||||||||||||||||||||||||||||||||
| 4.11 غ·سم−3 | ||||||||||||||||||||||||||||||||||||||||
| 1941 ك، 1668 °س، 3034 °ف | ||||||||||||||||||||||||||||||||||||||||
| 3560 ك، 3287 °س، 5949 °ف | ||||||||||||||||||||||||||||||||||||||||
| 14.15 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||
| 425 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||
| (25 °س) 25.060 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
| 4, 3, 2, 1[1] (أكاسيده مذبذبة) |
||||||||||||||||||||||||||||||||||||||||
| 1.54 (مقياس باولنغ) | ||||||||||||||||||||||||||||||||||||||||
| الأول: 658.8 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||
| الثاني: 1309.8 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||
| الثالث: 2652.5 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||
| 147 بيكومتر | ||||||||||||||||||||||||||||||||||||||||
| 8±160 بيكومتر | ||||||||||||||||||||||||||||||||||||||||
| نظام بلوري سداسي | ||||||||||||||||||||||||||||||||||||||||
| مغناطيسية مسايرة | ||||||||||||||||||||||||||||||||||||||||
| 420 نانوأوم·متر (20 °س) | ||||||||||||||||||||||||||||||||||||||||
| 21.9 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||||||||||||||||||
| 8.6 ميكرومتر·متر−1·كلفن−1 (25 °س) | ||||||||||||||||||||||||||||||||||||||||
| (درجة حرارة الغرفة) 5,090 متر·ثانية−1 | ||||||||||||||||||||||||||||||||||||||||
| 116 غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||
| 44 غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||
| 110 غيغاباسكال | ||||||||||||||||||||||||||||||||||||||||
| 0.32 | ||||||||||||||||||||||||||||||||||||||||
| 6.0 | ||||||||||||||||||||||||||||||||||||||||
| 970 ميغاباسكال | ||||||||||||||||||||||||||||||||||||||||
| 716 ميغاباسكال | ||||||||||||||||||||||||||||||||||||||||
| 7440-32-6 | ||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر التيتانيوم | ||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
| ع · ن · ت | ||||||||||||||||||||||||||||||||||||||||
تيتانيوم هو عنصر كيميائي في الجدول الدوري ورمزه Ti ورقمه الذري 22. فلز انتقالي خفيف الوزن، قوي، ذو لمعان ومقاوم للصدأ (بما فيه ماء البحر والكلور)، ولونه معدني أبيض فضي.
ويستخدم التيتانيوم في السبائك القوية خفيفة الوزن (وخصوصاً مع الحديد والألومنيوم) وأكثر مركباته شيوعاً هي ثاني أكسيد التيتانيوم، والذي يستعمل في الصبغات البيضاء. ومن استخدامات تلك الصبغات البيضاء: سائل تصحيح الطباعة الأبيض Correction fluid والبويات البيضاء. ويستخدم كذلك في معجون الأسنان، علامات الطريق البيضاء، وفي الألعاب النارية البيضاء اللون.
محتويات
تيتانيوم هو عنصر كيميائي في الجدول الدوري ورمزه Ti ورقمه الذري 22. فلز انتقالي خفيف الوزن و له خواص فيزيائية متعددة : فإنه يكون لامع (له بريق) ذو كثافة عالية. يمكن سحبه، يمكن طرقه، وغالبا درجة انصهاره عالية نسبيا تقدرب أكثر من 1650 درجة مئوية أو 3000 درجة فهرنهايت. كما أنه صلب وناقل جيد للكهرباء والحرارة. ويرجع هذا بصفة عامة لكثافته القليلة.وطراوته عن المعادن الأخرى. وتحدث خاصية التواصل غالبا لأن كل ذرة يكون بها الكترونات غير مرتبطة جيدا في مداره الأخير (إلكترون التكاثر) وعلى هذا يتكون مايشبه البحر حول كاتيون نواة الفلز مما يسبب خاصية التواصل. تستخدم القوات المسلحة كميات هائلة من التيتانيوم في الطائرات والمحركات النفاثة لأنها قوية وخفيفة. يستطيع مقاومة درجات الحرارة حتى درجة 427°م والتي تجعل منه فلزًا مفيدًا في أنواع متعددة من الآليات
الكيميائية
معظم المعادن غير ثابتة كيميائيا، تتفاعل مع الأكسجين في الهواء لتكوين أكاسيد بمرور الوقت (الحديد يصدأ على مر السنين، يحترق البوتاسيوم في ثواني : الفضة تفقد لمعانها في شهور) اما التيتانيوم مقاوم التآكل أو الصدأ الناتج عن مياه البحر أو بخار البحر مثله في ذلك مثل البلاتين. وفي هذه الخاصية يفوق الفولاذ الذي لا يصدأ. ولا تؤثر الحموض أو ماء القلويات عالية التآكل على التيتانيوم. وهو فلز قابل للطرق، وله معدل قوة ـ وزن أعلى من الفولاذ. وجميع هذه الصفات تجعل منه فلزًا ذا أهمية كبرى. التيتانيوم يتفاعل بسهولة مع الأكسجين في 1200 درجة مئوية (2190 درجة فهرنهايت) في الهواء، وعند درجة حرارة 610 (1130 درجة فهرنهايت) في الأكسجين النقي، والتي تشكل ثاني أكسيد التيتانيوم. ونتيجة لذلك، لا ينبغي تذويب هذا المعدن في الهواء الطلق فانه يحترق قبل الوصول إلى نقطة الذوبان. ذوبان غير ممكن إلا في جو خامل أو في فراغ. عند درجة حرارة 550درجة مئوية (1022 درجة فهرنهايت)، فهو يجمع مع الكلور. ويتفاعل أيضا مع الهالوجينات الأخرى، ويمتص الهيدروجين. التيتانيوم هو أحد العناصر القليلة التي تحرق في غاز النيتروجين النقي، وكرد فعل على 800 درجة مئوية (1470درجة فهرنهايت) لتشكيل نيتريد التيتانيوم، والذي يسبب التقصف.
وقد أظهرت التجارب أن التيتانيوم يصبح المشعة طبيعيا بعد فقدان الكترون، وانبعاث البوزيترون مما يؤدي إلى انبعاث الاشعة.
المركبات
عدد الأكسدة +4 يهيمن الكيمياء التيتانيوم ولكن المركبات في حالة الأكسدة +3 شائعة أيضا. لأنها اعداد أكسدة عالية العديد من مركبات التيتانيوم لها درجة عالية من خلال الترابط التساهمي. الصفير والياقوت ستار يتم الحصول عليهما من الشوائب ثاني أكسيد التيتانيوم الموجودة فيه. تيتانات هي مركبات المصنوع من ثاني أكسيد التيتانيوم، تيتانات الباريوم له خصائص كهرضغطية، مما يجعل من الممكن استخدامها بمثابة محول الصوت والكهرباء. تتشكل عسترات من التيتانيوم من خلال تفاعل الكحول ورابع كلوريد التيتانيوم وتستخدم لأقمشة مقاومة للماء. رابع كلوريد التيتانيوم TiCl4، التي تسمى أحيانا "دغدغة" هو سائل اصفراللون والذي يستخدم كمادة وسيطة في صناعة ثاني أكسيد التيتانيوم للدهان. يستخدم على نطاق واسع في الكيمياء العضوية، حمض لويس على سبيل المثال في الثكاثف، وكلوريد التيتانيوم الثالث (TiCl3)، والذي يستخدم كعامل مختزل.
الظهور
دائما المستعبدين التيتانيوم إلى عناصر أخرى في الطبيعة. ذلك هو العنصر الأكثر وفرة وهو من المعادن التاسعة وخمسون المكونة للقشرة الأرضية ونسبته (0.63 ٪ من كتلتها)، وهو من المعادن السابعة والخمسين الأكثر وفرة. وهو موجود في معظم الصخور البركانية والرواسب والمشتقة منها (وكذلك في الكائنات الحية والهيئات الطبيعية من الماء). من 801 أنواع من الصخور البركانية التي حللها المصح الجيولوجي بالولايات المتحدة، التيتانيوم حصته في التربة حوالي 0،5 حتي 1،5 ٪.
يتم توزيعها على نطاق واسع ويحدث أساسا في المعادن، وكذلك في العديد من خامات الحديد. وله اهمية اقتصادية، والتيتانيوم موجود في غرب أستراليا، كندا، الصين، الهند وموزامبيق ونيوزيلندا والنرويج وأوكرانيا. يستخرج أيضا بكميات كبيرة من الروتيل في أمريكا الشمالية وجنوب أفريقيا والمساعدة في الاسهام في الإنتاج السنوي من 90000 طن من المعادن و 4.3 مليون طن من ثاني أكسيد التيتانيوم. تقدر مجموع الاحتياطيات من التيتانيوم ليتجاوز 600 مليون طن.
النظائر
طبيعيا التيتانيوم تتألف من 5 نظائر مستقرة : 46Ti، 47Ti، 48Ti، 49Ti، و50Ti، مع 48Ti كونها الأكثر وفرة (73.8 ٪ وفرة الطبيعية). اتسمت أحد عشر النظائر المشعة، مع 44Ti الأكثر ثباتا مع نصف عمر 63 عاما، 45Ti وله عمر نصف 184.8 دقيقة، 51Ti وله عمر نصف 5.76 دقيقة، و52Ti وله عمر نصف 1،7 دقائق. وكل النظائر المشعة المتبقية لها عمر نصف التي هي أقل من 33 ثانية، وغالبيتها لها نصف عمر أقل من نصف ثانية.
وتتراوح نظائر التيتانيوم في الوزن الذري من 39،99 (40Ti) إلى 57،966 (58Ti). ونظام التهافت الأساسي قبل أكثر النظائر ثباتا وفير، 48Ti، هو أسر الإلكترون في النظام الأساسي بعدها يحدث إنبعاث اشعة بيتا. المنتجات التهافت الأساسي قبل 48Ti هي العنصر 21 (سكانديوم) والمنتجات الأولية بعد العنصر 23 (الفاناديوم).
تاريخ

![]() مارتن كلابروث هاينريش اسمه التيتانيوم لجبابرة من الأساطير اليونانية.
مارتن كلابروث هاينريش اسمه التيتانيوم لجبابرة من الأساطير اليونانية.
ان أول البدايات لاكتشاف معدن التيتانيوم تعود إلى الكيميائي البريطانيو والجيولوجي (ويليام جريجور) وهو أول من اكتشف وجود التيتانيوم خام معدني رملي بالقرب من بلدة ميناكان فاطلق عليه اسم ميناكانايت وكان ذلك في عام 1791م. ثم عثر عليه الكيميائي الألماني مارت ن كلابروث في عام 1795 م واعطاه اسما جديدا وهو التيتانيوم، المعروف به حتى الآن وهو مشتق من تيتان اي ابن الأرض.. ونظرا لان وسائل النشر العلمي لم تكن متاحه بما فيه الكفاية آنذاك فإنه لم تنشأ اي علاقة علمية بين العالمين، لذلك مرت سنتان كاملتان قبل أن يدرك جريجور وكلابروث انهما قد اكتشفا معدنا واحد. وقد وجدا الرجلان عن طريق بعض التحاليل الكيميائية إلى وجود التيتانيوم الخام الطبيعي غير ان ذلك لم يكن يعني عثورهما على المعدن نفسه خالصا.. والحقيقة انهما لم يكتشفا ألا واحدا من أهم مركبات التيتانيوم في الطبيعة وهو ثاني اكسيد التيتانيوم وهو عبارة عن مسحوق أبيض اللون من البلورات الدقيقة. والعمليات اللازمة لاستخراج خامات التيتانيوم المختلفة وشاقة ومكلفة، بل ليس من الممكن بالطريقة العادية، عن طريق تسخين في وجود الكربون، التي ينتج بسبب كربيد التيتانيوم الصرفة التيتانيوم المعدنية (99.9 ٪) وقد أعد أول مرة في عام 1910 من قبل ماثيو ألف صياد في رينسيلار معهد البوليتكنيك عن طريق تسخين TiCl4 مع الصوديوم على 700-800 درجة مئوية في عملية هنتر. وأنتجت شركة دو بنت الفلز تجاريًا للمرة الأولى عام 1948م. وفي الوقت الحاضر لا زال الإنتاج منخفضًا بسبب صعوبة وتكلفة فصل التيتانيوم عن الخام الذي يوجد به. وتُصنِّع الولايات المتحدة الأمريكية معظم الفلز المكرّر. وتنتج اليابان وبريطانيا كذلك التيتانيوم. وما زالت الأبحاث جارية لزيادة توريده وتقليل تكلفته.

![]() التيتانيوم الاسفنج، والذي أدلى بهكرول عملية
التيتانيوم الاسفنج، والذي أدلى بهكرول عملية
لم يستخدم معدن التيتانيوم خارج المختبر حتى 1932 عندما ويليام جوستين كرول أثبت أنه يمكن أن تنتج عن طريق تافعل رابع كلوريد التيتانيوم (TiCl4) مع الكالسيوم. وتعد ثماني سنوات هو صقل هذه العملية باستخدام المغنيسيوم والصوديوم وحتى في ما أصبح يعرف باسم عملية كرول. على الرغم من أن الأبحاث لا تزال متواصلة في استخراج عمليات أكثر كفاءة وأقل تكلفة (على سبيل المثال، الأولى للتمويل كامبردج)، لا تزال تستخدم في عملية كرول للإنتاج التجاري. ويعمل فلز التيتانيوم كعنصر سبك مهم. تستخدم القوات المسلحة كميات هائلة من التيتانيوم في الطائرات والمحركات النفاثة لأنها قوية وخفيفة. وهو يستطيع كذلك مقاومة درجات الحرارة حتى درجة 427°م والتي تجعل منه فلزًا مفيدًا في أنواع متعددة من الآليات. وبسبب خصائصه العالية، فإن للتيتانيوم عدداً من الاستخدامات المحتملة مثل الألواح المدرعة للسفن وريش التربينة البخارية، والأجهزة الجراحية والأدوات. تستخدم صناعة النقل مركبات هائلة من التيتانيوم من الحافلات وقطارات السكك الحديدية والسيارات، إذا خُفِّض سعر التيتانيوم بحيث ينافس سعر الفولاذ الذي لا يصدأ. في عام 1950م و 1960م كان الاتحاد السوفياتي رائدا في استخدام التيتانيوم في التطبيقات العسكرية والغواصات (الفا من الدرجة الأولى والدرجة مايك) كجزء من البرامج ذات الصلة إلى الحرب الباردة. وابتداء من أوائل 1950، بدأ استخدام التيتانيوم على نطاق واسع لأغراض الطيران العسكري، وخاصة في طائرات عالية الأداء، بدا من الطائرات مثل سوبر F100 سيبر وشركة لوكهيد أ-12.
التطبيقات

![]() اسطوانة من التيتانيوم, "الصف 2 "نوعية"
اسطوانة من التيتانيوم, "الصف 2 "نوعية"
ويستخدم التيتانيوم في الصلب كعنصر صناعة السبائك (سبائك الحديد والتيتانيوم) لتقليل حجم الحبوب ولتفادي الاكسدة مع المؤثرات الخارجية، ويخلط مع الفولاذ لمقاوم الصدأ لخفض محتوى الكربون. مخلوط هو غالبا التيتانيوم مع الالومنيوم (لتحسين حجم الحبوب)، والفاناديوم، النحاس (لتصلب)، والحديد، المنغنيز، الموليبدينوم، ومع معادن أخرى.
وهو مطلوب بكثرة في صناعة المنتوجات ويكون الطلب عليه من قبل مصانع التيتانيوم على حسب المثال شركات ورق، الخشب،، والأسلاك، المطروقات، وسبائك يمكن العثور عليها في الصناعة الترفيهية، والفضاء، والناشئة الأسواق. يستخدم مسحوق التيتانيوم في الالعاب النارية كمصدر للجسيمات حرق مشرق. .
أصباغ والمواد المضافة والطلاءات

![]() ثاني أكسيد التيتانيوم هو المركب الأكثر استخداما من التيتانيوم
ثاني أكسيد التيتانيوم هو المركب الأكثر استخداما من التيتانيوم
ثاني أكسيد التيتانيوم هو المركب الأكثر استخداما من 95 ٪ من خام التيتانيوم المستخرج من الأرض المخصصة لتكرير ثاني أكسيد التيتانيوم (TiO2)، وهو الصباغ الأبيض بشكل مكثف دائم يستخدم في الطلاء والورق ومعجون الأسنان، والبلاستيك. وكما يستخدم في صناعة الاسمنت، والأحجار الكريمة، وباعتبارها البصرية لامع، وعامل في تعزيز قضبان الجرافيت مركبات الصيد ونوادي الغولف.
مسحوق TiO2 هو خامل كيميائيا، يقاوم تلاشى في ضوء الشمس،. ثاني أكسيد التيتانيوم له خاصية كبيرة أو عالية جدا من الانكسار والتشتت البصري أعلى من الماس. وبالإضافة إلى كونه الصباغ مهم جدا، كما يستخدم ثاني أكسيد التيتانيوم في واقيات الشمس نظرا لقدرتها على حماية الجلد من تلقاء نفسه. في الآونة الأخيرة، وأكسيد التيتانيوم وضعت لاستخدامها في أجهزة تنقية الهواء (كما هو طلاء تصفية)، أو في فيلم ويستخدم كمعطف على المباني بحيث يصبح عرضة للأشعة فوق البنفسجية (الطاقة الشمسية أو الاصطناعية) والرطوبة في الهواء، والأنواع الأكسدة مثل رد الفعل الهيدروكسيلي ويتم إنتاج الجذور حتى يتمكنوا من تنقية الهواء أو إبقاء نافذة السطوح نظيفة.
الفضائية الجوية والبحرية
التيتانيوم لديه كثافة عالية مما يؤدي إلىقوة الشد كبيرة والمقاومة للتآكل عالية، مقاومة التعب، وارتفاع مقاومة التشقق، والقدرته على تحمل درجات الحرارة معتدلة عالية، تستخدم سبائك التيتانيوم في الطائرات والمدرعات والطلاء، ويستخدم في السفن البحرية وسفن فضائية وصواريخ. للحصول على التطبيقات سبائك التيتانيوم مع الالومنيوم، والفاناديوم، والعناصر الأخرى لمجموعة متنوعة من المكونات بما في ذلك أجزاء الهيكلية الحرجة، في جدران النار، والهبوط، والعادم القنوات (الهليكوبتر)، والأنظمة الهيدروليكية. في الحقيقة، يستخدم التيتانيوم في إنتاج محركات الطائرات والإطارات. وريال - 71 "البلاكبيرد" كانت واحداة من أول طائرات المستفيدة واسعة من التيتانيوم ضمن هيكلها، مما يمهد الطريق لبه استخدامها في الحديث الطائرات العسكرية والتجارية. ويستخدم ما يقدر بنحو 59 ألف طن متري في طائرة بوينغ 777، في 45 بوينغ 747، و 18 في 32 طائرة بوينج 737، وفي طائرات إيرباص A340، في 18 ايرباص A330، و 12 في ايرباص A320. ويجوز للطائرة ايرباص A380 استخدام 146 طن متري، بما في ذلك نحو 26 ألف طن في محركات في تطبيقات المحرك، يتم استخدام التيتانيوم عن الدوارات، وشفرات الضاغط، ومكونات النظام الهيدروليكي،. نظرا لمقاومته للتآكل عالية لمياه البحر، ويستخدم التيتانيوم لجعل المروحة مهاوي والتزوير ومبادلات حرارية في محطات تحلية المياه؛ في المبردات، سخان المياه المالحة لأحواض السمك، صيد الأسماك، وزعيم خط، والسكاكين الغواصين '. ويستخدم التيتانيوم لتصنيع العلب وغيرها من عناصر مراقبة المحيطات ونشر أجهزة رصد للاستخدام العلمية والعسكرية. وضعت الاتحاد السوفياتي السابق تقنيات لصنع غواصات إلى حد كبير من التيتانيوم.
الصناعية

![]() ارتفاع نقاء (99.999 ٪) التيتانيوم مع مرئية التركيب البلوري
ارتفاع نقاء (99.999 ٪) التيتانيوم مع مرئية التركيب البلوري
يستخدم التيتانيوم في الأنابيب الملحومة ومعدات عملية (مبادلات حرارية، والدبابات والسفن وعملية، والصمامات) في الصناعات الكيماوية والبتروكيماوية في المقام الأول لمقاومة التآكل. وتستخدم سبائك محددة في اسفل وتطبيقات معالجة للخامات بالمحاليل المائية النيكل بسبب قوتها عالية (على سبيل المثال : سبائك التيتانيوم جيم بيتا)،ويستخدم أيضا في صناعة لب الورق والورق يستخدم التيتانيوم في المعدات تتعرض لعملية تآكل ووسائل الاعلام مثل هيبوكلوريت الصوديوم أو الرطب غاز الكلور تطبيقات أخرى تشمل : لحام بالموجات فوق الصوتية، موجة حام، والأهداف الاخرق. رابع كلوريد التيتانيوم (TiCl4)، وهو سائل عديم اللون، المهم كمادة وسيطة في عملية صنع TiO2.
المستهلك والمعمارية

![]() من التيتانيوم يرمى مفيدة للحقائب على ظهورهم. حوالي 16غرام وأخف وزنا من الصلب ولكن إناء من البلاستيك أقوى من تنفيذ.
من التيتانيوم يرمى مفيدة للحقائب على ظهورهم. حوالي 16غرام وأخف وزنا من الصلب ولكن إناء من البلاستيك أقوى من تنفيذ.
![]() مميز لحام الخرز على التيتانيوم دراجة الإطار التي أدلى بها حرفي ماهر.
مميز لحام الخرز على التيتانيوم دراجة الإطار التي أدلى بها حرفي ماهر.
![]() ومتحف غوغنهايم بلباو هو مغمد في ألواح التيتانيوم.
ومتحف غوغنهايم بلباو هو مغمد في ألواح التيتانيوم.
ويستخدم معدن التيتانيوم في تطبيقات السيارات، وخاصة في سباقات السيارات أو الدراجات النارية، حيث تخفيض الوزن أمر بالغ الأهمية مع الحفاظ على قوة وصلابة عالية. التيتانيوم كلفة عالية لجعلها قابلة للتسويق في السوق الاستهلاكية العام، بخلاف المنتجات النهائية، لا سيما بالنسبة للسباق / أداء السوق. وقد تم في وقت متأخر نموذج السفينة الحربية المتاحة مع عوادم التيتانيوم. ويستخدم التيتانيوم في العديد من السلع الرياضية : مضارب التنس ونوادي الجولف، ؛ مشاوي خوذة، والهوكي، درجات، وكرة القدم، وإطارات الدراجات الهوائية والمكونات. على الرغم من أن المادة ليست التيار الرئيسي لإنتاج دراجات، وقد استخدمت من قبل فرق الدراجات التيتانيوم سباق الدراجات الهوائية والمغامرة، وتستخدم أيضا سبائك التيتانيوم في إطارات النظارات. هذه النتائج في إطار دائم مكلفة نوعا ما، ولكن دائم للغاية وطويلة وهو خفيف الوزن ويسبب أي حساسية الجلد. الحقائب على ظهورهم معدات تستخدم العديد من التيتانيوم، بما في ذلك تجهيزات المطابخ وأدوات الطعام، والفوانيس، والرهانات خيمة. على الرغم من تكلفة أكثر قليلا من الصلب التقليدية أو بدائل الألومنيوم، وهذه المنتجات التيتانيوم يمكن أخف وزنا كبيرا دون المساس قوة. بسبب متانتها، أصبح أكثر شعبية التيتانيوم لمصمم مجوهرات (وخاصة، وخواتم التيتانيوم) يجعل من اختيار جيد لأولئك الذين يعانون من الحساسية أو أولئك الذين سوف يرتدون المجوهرات في بيئات مائية مثل حمامات السباحة. متانة التيتانيوم، وخفيفة الوزن، ومقاومة للتآكل يجعلها مفيدة في إنتاج. بعض الفنانين ينتجون الاعمال الفنية مثل الثماثيل وغيرها من ديكور والاثاث بواسطة التيتانيوم. قد يكون أحيانا التيتانيوم المستخدم في التطبيقات المعمارية : م 40 (131 قدم) نصب تذكاري ليوري غاغارين، أول رجل من السفر في الفضاء، في موسكو، ومصنوع من التيتانيوم للون المعدن جذابة و. ومتحف غوغنهايم بلباو والألفية مكتبة سيريتوس المباني الأولى في أوروبا وأمريكا الشمالية. نظرا لقوتها الفائقة وخفة الوزن بالمقارنة مع المعادن الأخرى التي تستخدم عادة في الأسلحة النارية (الصلب والفولاذ المقاوم للصدأ، والألومنيوم)، والتقدم في تقنيات تصنيع المعادن، أصبح استخدام التيتانيوم أكثر انتشارا في صناعة الأسلحة النارية. الاستخدامات الأساسية تشمل مسدس واسطوانات مسدس. كما انه استخدم في صناعة أجهزة الكمبيوتر المحمول.
.
الطبية
زرع العظام
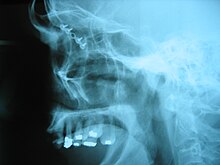
![]() وكسر في العين المقبس تم إصلاح عن طريق تثبيت وكسر العظام مع الصغيرةالتيتانيوم لوحات ومسامير.
وكسر في العين المقبس تم إصلاح عن طريق تثبيت وكسر العظام مع الصغيرةالتيتانيوم لوحات ومسامير.
لأنه متوافق حيويا (غير سامة وليس مرفوضا من قبل الجسم)، ويستخدم التيتانيوم في مجموعة كاملة من التطبيقات الطبية بما في ذلك العمليات الجراحية وتنفذ عملية زرع، مثل استبدال المفاصل التي يمكن أن تبقى في مكانها لمدة تصل إلى 20 عاما. التيتانيوم والخصائصه الخاصة يتيح استخدامه في زراعة الأسنان التي يمكن أن تبقى في مكانها لأكثر من 30 عاما. هذه الخاصية مفيد أيضا للتطبيقات زرع العظام. هذه الاستفادة من المعامل أقل مرونة من التيتانيوم (معامل يونغ) على نحو أوثق المباراة التي من العظام التي تهدف إلى إصلاح هذه الأجهزة. ونتيجة لذلك، يحمل الهيكل العظمي أكثر أي مشابه بين العظام وزرع، مما أدى إلى انخفاض معدل تدهور العظام بسبب الإجهاد وكسور العظام التي تحدث و التيتانيوم ليس له خاصية المغناطيس، وهاذا يخص المرضى الذين يعانون من زرع الأعضاء من معدن التيتانيوم انهم بامان عند فحص بالتصوير بالرنين المغناطيسي (ملائمة للزراعة على المدى الطويل).
الثقب
الخصائص وقدرتها على ان تكون ملونة جذابة تجعل من معدن شعبية للاستخدام في ثقب الجسم، ويمكن للتيتانيوم لإنتاج الألوان المختلفة، والتي يتفاوت سمك سطح طبقة الأكسيد وأسباب هامش تدخل.
أخرى
كما يستخدم التيتانيوم لالأدوات الجراحية المستخدمة في الجراحة صورة موجهة، وكذلك الكراسي المتحركة والعكاكيز، وأية منتجات أخرى حيث القوة العالية وانخفاض الوزن ومرغوب فيه.



ساحة النقاش