حمض أميني
الأحماض الأمينية (بالإنجليزية: Amino Acid) هي لبنات البناء الرئيسية لبناء البروتين والببتيد في الجسم. يمكن ملاحظتها بسهولة بعد هضم البروتين. ثمانيه أساسية مهمة جدا (لا يمكن للجسم البشري أن يصنعها بنفسه) والباقي غير أساسية (يمكن صنعها داخل الجسم البشري، بشرط التغذية السليمة). بالرغم من قدرة الجسم على تصنيع الأحماض غير الأساسية، إلا أنه وفي بعض الأحيان يتوجب أخذ مكملات للأحماض غير الأساسية لضمان توفر الكميه المثلى في الجسم. البعض يضيف قسما ثالثا هو شبه-أساسية، حيث يقوم الجسم بتصنيع هذه الأحماض ولكن بكميات محدودة.
إضافة إلى بناء الخلايا وإصلاح الانسجه، الاحماض الامينيه تشكل مادة البناء الرئيسية للاجسام المضاده لمكافحة غزو البكتريا والفيروسات، وهي تشكل جزءا أساسيا من نظام الانزيمات والهرمونات؛ وهي تبني البروتينات النووية، رنا (الحَمْضُ النَّوَوِيِّ الرِّيبِي) ودنا (الحَمْضُ الرِّيْبِيُّ النَّوَوِي المَنْزُوع الأوكسِجين). كما تقوم الأحماض الأمينية بدور رئيسي بحمل الاوكسجين إلى أنحاء الجسم المختلفة، وهي مكون أساسي للنشاط العضلي.
نظريا يوجد 64 نوع منها، فالدنا تبنى من 4 روامز هي A، C، G، T وتبنى الأحماض عادة بتركيب عدة روامز، مثل GCA, GCC, GCG. لكن المتوفر في إجسام الكائنات الحية هي أقل من ذلك، ما بين 20 إلى 26 نوع من الأحماض الأمينية. مع ملاحظة أن الكثير منها يتشكل باكثر من ثلاث روامز وقد تصل إلى 6 والبعض منها مكون فقط من رامز واحد.
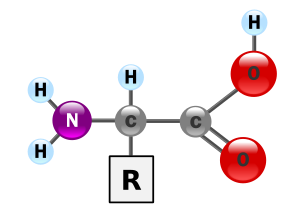
الحمض الأميني هو أحد مركبات عضوية تحمل نوعين من الجذور الكيميائية، وهي جذر أميني (نشادري) [1] NH2 − وجذركربوكسيل COOH متحدتين مع ذرة كربون مرتبطة بدورها بسلسلة عضوية جانبية Side chain R تكون مختلفة من حمض أميني إلى آخر. تعتبر الحموض الأمينية وحدة التركيب الأساسية للبروتينات في الكائنات الحية.
ترقم ذرات الكربون عادة بالأحرف الإغريقية، وتنتمي الحموض الأمينية المكونة للبروتينات إلى فئة ألفا α-Amino Acids وذلك لأن جذري الأمين والهيدروكسيل يرتبطان بذرة الكربون الأولى في السلسلة. وتوجد كذلك حموض أمينية أحيائية من فئة بيتا مثل البيتا-ألانين (بالإنجليزية: β-Alanine) وأخرى من فئة جاما مثل حمض الجاما-بيتيريك (بالإنجليزية: γ-Aminobutyric acid) أو (بالإنجليزية: GABA). ورغم وجود عدد كبير من الحموض الألفا-الأمينية في الطبيعة إلا أن السلاسل البروتينية لا تحتوي سوى 20 نوعا منها فقط. وتضطلع الحموض الأمينية بمهام أخرى كلعبها دور نواقل عصبيةومواد أولية لبعض الهرمونات أو كمصدر للطاقة. و تتوفر أيضا مجموعة من الحموض الأمينية المخلقة(المصطنعة) كيميائيا ولها عديد الاستعملات في مجال الصناعة الكيميائية والصيدلية والغذائية.
محتويات[أخف] |
[عدل]البنية الكيميائية العامة
يعتبر هيدروكسي كرباميد (بالإنجليزية: Hydroxycarbamide) الحمض الأميني الأبسط من حيث التركيب فهو متكون من جذر أميني متصل مباشرة بكربون جذر الهيدروكسيل. وهذا المركب غير أحيائي. أما في بقية الأحماض الأمينية فتدخل ذرة أو أكثر من الكربون بين هذين الجذرين. ويحدد موقع الأمين في السلسلة الكربونية الفئة التي ينتمي إليها الحمض الأميني كما يلي:

 هو المجموعة الجانبية التي تحدد طبيعة كل حمض الأميني.
هو المجموعة الجانبية التي تحدد طبيعة كل حمض الأميني.
- حموض ألفا-أمينية، حيث يتصل جذر الأمين بالكربون رقم 2 بعد كربون جذر الهيدروكسيل ويرقم بألفا Cα. يسمى المركب بالحمض 2-أمينوايتانويك Aminoethanoic acid، أو ما يعرف بالغليسين Glycine، أبسط الحموض الأمينية لدى الكائنات الحية. أما بقية الأحماض الألفا-أمينية فلها نفس البنية مع اختلاف في السلسلة الجانبية R، فعوضا عن ذرةالهيدروجين المرتبطة بالكربون ألفا في الغليسين، تتخذ أنواع مختلفة، على سبيل المثال، جذر المثيل Methyl في حالة الألانين Alanine أو جذر مختلف الحلقة Heterocyclic بالنسبة للتريبتوفان Tryptophan. والدور الأساسي للأحماض الألفا-أمينية هو بناء مختلف البروتينات.
- حموض بيتا-أمينية، يرتبط جذر الأمين بالكربون الثالث بداية من كربون جذر الهيدروكسيل Cβ، وأبسط ممثل أحيائي لهذه الفئة هو البيتا-ألانين، يتأتي من تحلل الكارنوسين Carnosine، ويلعب دور ناقل عصبي مثبط للغليسين.
- حموض جاما-أمينية، يتحد جذر الأمين بالكربون الرابع بعد كربون جذر الهيدروكسيل Cγ، المثال المعروف في هذه الفئة هو حامض الجاما-بيتيريك GABA، وهو كذلك ناقل عصبي مثبط.
[عدل]التماثلية البصرية (التناظر)
لدى جميع الأحماض الألفا-أمينية، باستثناء الجليسين، يكون الكربون-ألفا مرتبطا بجذور مختلفة ومجموعة جانبية R مميزة لذى نقول أنه كايرالي Chiral أو مركزناشط بصريا. ونتيجة لهذه الخاصية، فان كل حمض ألفا-أميني متواجد في الطبيعة على شكل نظيرتين بصريتين Stereoisomers، يمينية Dextrogyre ويرمز لها، في الكيمياء الحيوية، بـ D، أو يسارية Levogyre ويرمز لها بـ L. ومعنى ذلك فيزيائيا أنها تقوم بازاحة الضوء المستقطب بزاوية معينة اما باتجاه عقارب الساعة بنسبة للنضيرة D، وهو الاتجاه الموجب (+)، أو ضد اتجاه عقارب الساعة بنسبة للنضيرة L، وهو الاتجاه السالب (-). وبالنسبة لنظام التسمية R / S، الأكثر استعملا في الكيمياء العضوية، فان نفس المبدأ يتبع حسب قاعدة "كان إنجولد بريلوج" فــ D == R وL == S.
ولا تنطبـق هـذه القـاعدة الا على السيستيـن (بالإنجليزية: Cysteine) لأن الجذر الكبريتي ليسـت له الأولوية في هذه الحالــة. اذن فالـ D -سيستين هو الـ S -سيستين، والـ L -سيستين هو الـ R -سيستين [2].
و في المثال الموجود على النموذج المقابل، نجد الـ D -ألانين وكأنه صورة عبر المرآة لالـ L -ألانين، وهما مركبان لا يمكن مطابقتهما non-superimposable، تماما كما لا يمكن مطابقة قفى اليد اليمنى مع ظهر اليد اليسرى صورة. ولسبب لا يزال محيرا، فان غالبية الأحماض الألفا-أمينية المكونة للبروتينات هي من النضيرة L وليست D. ولكن يمكن أن نجد بعض الـD-أحماض أمينية في أنواع مـن الصدفيات [3] مثل عائلة الكونيدات Conidae، وفي الغشاء البيبتدوسكري Peptidoglycan لبعض البكتيريا [4].
[عدل]تصنيف الأحماض الأمينية
تقسم الأحماض الألفا-أمينية العشرون الموجودة في البروتينات، والمشفرة في المعلومة الوراثية، إلى مجاميع حسب عدد من الخصائص الفيزيائية، الكيميائية والأحيائية :
- الطبيعة الكيميائيـة للسلسلة الجانبيـة : بما أن المجموعة الجانبية R هي التي تحدد هوية الحمض الأميني، يمكن اذن تقسيم الأحماض الأمينية إلى ذات سلسلة هيدروكاربونية، اما أليفاتية Aliphatic أو أروماتية Aromatic أو مختلفة الحلقة Heterocyclic.
- القطبيـة الكهربائيـة : تقسم الأحماض الأمينية حسب قطبيتها الكهربائية، وذلك حسب حالة التأين، إلى قطبية Polar (سالبة أو موجبة الشحنة) أو غير قطبية Nonpolar (عديمة الشحنة). تحدد هذه الخاصية المهمة قابلية الأحماض الأمينية للانحلال في الماء (و الماء هو محلول قطبي)، فتكون الأحماض الأمينية ذات المجاميع الجانبية R القطبية متجاذبة مع الماء Hydrophilic، وهي عادة ما تكون على الجزء الخارجي للبروتينات. بينما الأحماض الأمينية ذات السلاسل الجانبية غير القطبية، وغير المتجاذبة مع الماء Hydrophobic، تميل إلى التجمع للداخل.

- القاعديـة \ الحمضيـة : السلسلة الجانبية R من الممكن أن تكون قاعدية، مثل حمض الليسين Lysine أو الأرجنين Arginine وهو شديد القاعدية، أو حمضية، مثل الجلوتميت Glutamic acid والأسبارتيت Aspartic acid، أو متعادلة مثل الجليسين والليوسين Leucine. وعادة ما تكون الأحماض الأمينية ذات المجاميع الجانبية القاعدية والحمضية قطبية جدا وهي توجد بصورة كبيرة على سطح البروتينات المماس للماء.
- يمكن أيضا أن نقسم الأحماض الأمينية حسب أهميتها الغذائية وتوفرها الأحيائي إلى :
- أحماض أمينية أساسية Essential لا يصنعها الجسم، ويجب تناولها في الغذاء. مثال، الليوسين والليسين.
- أحماض أمينية شبه-أساسية Semi-essential يستطيع الجسم تخليقها ولكن ليس بكميات كافية، خاصة في مرحلة النمو، ويحبذ أن تتوفر في الغذاء. مثال، الأرجنين والهستيدين Histidine.
- أحماض أمينية غير أساسية Nonessential متوفرة في الجسم السليم بكميات دائمة، ولا تستلزم حضورها في الغذاء. مثال، الجليسين والبرولين Proline.
[عدل]قــائمة تصنيف الأحمــاض الألفا-الأمينيـة المكونة للبروتينات[5]
أنظر إلى المقال المفصل التالي قائمة الأحماض الأمينية
| ألانين Alanine |
Ala |
A |
89,1 |
غير قطبي |
متعـادل |
غير أساسي |
| أرجنين Arginine |
Arg |
R |
174,20 |
قطبي |
قاعـدي (قوي) |
شبه-أساسي |
| أسباراجين Asparagin |
Asn |
N |
132,12 |
قطبي |
متعـادل |
غير أساسي |
| أسبارتيت Aspartic acid |
Asp |
D |
133,10 |
قطبي |
حمضـي |
غير أساسي |
| سيستئين Cysteine |
Cys |
C (م) |
121,16 |
قطبي |
متعـادل |
غير أساسي(م م) |
| جلوتامين Glutamin |
Gln |
Q |
146,15 |
قطبي |
متعـادل |
غير أساسي |
| جلوتاميت Glutamic acid |
Glu |
E |
147,13 |
قطبي |
حمضـي |
غير أساسي |
| جليسين Glycine |
Gly |
G |
75,07 |
غير قطبي |
متعـادل |
غير أساسي |
| هيستدين Histidine |
His |
H |
155,16 |
قطبي |
قاعـدي (ضعيف) |
شبه-أساسي |
| ايزوليوسين Isoleucine |
Ile |
I |
131,17 |
غير قطبي |
متعـادل |
أساسـي |
| ليوسين Leucine |
Leu |
L |
131,17 |
غير قطبي |
متعـادل |
أساسـي |
| ليسين Lysine |
Lys |
K |
146,19 |
قطبي |
قاعـدي |
أساسـي |
| ميثيونين Methionine |
Met |
M |
149,21 |
غير قطبي |
متعـادل |
أساسـي |
| فينيلألانين Phenylalanine |
Phe |
F |
165,19 |
غير قطبي |
متعـادل |
أساسـي |
| برولين Proline |
Pro |
P |
115,13 |
غير قطبي |
متعـادل |
غير أساسي |
| سيرين Serine |
Ser |
S |
105,09 |
قطبي |
متعـادل |
غير أساسي |
| ثريونين Threonine |
Thr |
T |
119,12 |
قطبي |
متعـادل |
أساسـي |
| تريبتوفان Tryptophan |
Trp |
W |
204,23 |
قطبي |
متعـادل |
أساسـي |
| تيروسين Tyrosin |
Tyr |
Y |
181,19 |
قطبي |
متعـادل |
غير أساسي(م م) |
| فالين Valine |
Val |
V |
117,15 |
غير قطبي |
متعـادل |
أساسـي |
(م) رمز السيستين C يمكن أن يكتب أيضا S-HC، إذا كان الجذر الكبريتي (-HS) حرا أو S-SC، إذا كان هذا الجذر مرتبطا بجذر كبريتي لسيستين أخرى في السلسلة البيبتيدية. وتختلف الخاصيات أيضا في هذه الحالة، فالسيستين المرتبطة تصير غير قطبية.
(م م) هذه الأحماض الأمينية تصير أساسية في مراحل النمو الأولى وعند الأطفال.
[عدل]الخاصيات الكيميائية العامة
[عدل]تكون الرابط البيبتيدي

الرابط البيبتيدي : وهي الاصرة التي تتشكل بين جزيئتين عندما تتفاعل مجموعة الكربوكسيل للجزيئة الأولى مع مجموعة الامينو للجزيئة الثانية محررة جزيئة الماء (H2O) ويدعى هذا التفاعل بالتآلف الجاف وكذلك يسمى (تفاعل التكثيف) ويحدث بين الاحماض الامينية. أن الآصرة الناتجة من هذا التفاعل وهي CO-NH تسمى الاصرة البيبتيدية وتدعى الجزيئة الناتجة بالأميد، وألاميدات مركبات عضوية تحتوي مجموعة وظيفية تدعى الاميد وهي عبارة عن زمرة كربونيل متصلة بزمرة أمين.
[عدل]الخاصيات الأيونية والقطبية الكهربائية
[عدل]التفاعلات الكيميائية
1- الخواص الامينية للحوامض الامينية: بالنظر لاحتواء الحوامض الامينية على مجموعتين الأمين والكاربوكسيل لذا فأنها تعتبر ثنائية القطب أي تعمل كحامض أو كقاعدة وتسمى امفوتيرية أي تفقد وتكتسب بروتون لهذا فانها إذا وضعت في محاليل حامضية قوية PH = 1 تتقبل بروتون وتشحن (+) واذا وضعت في محاليل قاعدية قوية تفقد بروتون وتنشحن (-) اما في نقطة التعادل الكهربائي (Pl-) هي النقطة التي تتساوى فيها عدد (+) مع (-) وتكون PH معينة لكل حامض أميني كالاتي: أ- الحوامض الأمينية المتعادلة:- محصلة الشحنة = صفر P1=PH= (5-6.3) ب- القاعدية: محصلة الشحنة == صفر P1 = PH == (7.6-10.8) ج- الحامضية محلصة الشحنة == صفر P1 = PH == (2.97-3.2)
<p st

