<!--
<!--<!--<!--<!--<!--
<!--
<!--
<!--<!--
النبات و الماء 3 - الصفات الطبيعية و البنائية للماء
الدكتور/ عاطف محمد إبراهيم
الأستاذ بكلية الزراعة - جامعة الإسكندرية – مصر
<!--
<!--<!--
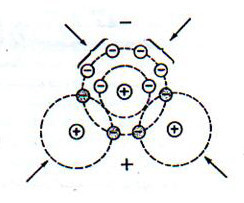
عند اتحاد ذرات الهيدروجين و الأوكسجين لتكوين الماء , يحث مشاركة لإلكتروناتها بطريقة تؤدي إلى تكوين جزيء ثابت , غير نشط , شكل (1 ). وعلى الرغم من أن جزيء الماء ككل متعادل كهربائياً , فإن التوزيع غير المتناظر ( المنتظم ) للإلكترونات تكون نتيجته أن أحد الجوانب يكون ذا شحنة موجبة مقارنة بالجانب الآخر. هذه الجزيئات التي يطلق عليها “dipoles” ترتب ذاتها في الحقل الكهربي بحيث يكون الجانب السالب في اتجاه الجانب الموجب و العكس بالعكس.
<!--<!--<!--
<!--<!--
<!--
<!--<!--
<!--
<!--<!--
شكل(1):يوضح التركيب البنائي لجزيء الماء مبيناً به الإلكترونات المشاركة و موضع الرابطة الهيدروجينية . عن Sutcliffe 1975:
<!--
<!--<!--
<!--
<!--<!--
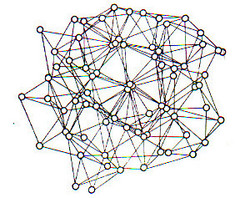
وعندما يحدث تجاذب بين المنطقة الموجبة لأحد الجزيئات و المنطقة السالبة للجزيء المجاور, تتكون الرابطة الهيدروجينية, وكنتيجة لوجود اثنين من البروتونات (+) و زوجين من الإلكترونات (- ) فإن جزيء الماء يستطيع تكوين أربعة روابط هيدروجينية مع الجزيئات المحيطة. تميل هذه الروابط للترتيب بصورة رباعية و كنتيجة لذلك فإن جزيئات الماء عند تجمدها و تحولها لصورة الثلج فإنها تأخذ شكل بلورات رباعية الشكل , شكل (2). و بارتفاع درجة الحرارة يقل وجود الرابطة الهيدروجينية , ولو أن بعضها يظل موجوداً حتى على درجة الغليان . و الرمز الكيميائي لجزيء الماء سواء أكان في الحالة السائلة أو الصلبة هو (H2O)n حيث تقل قيمة n بارتفاع درجة الحرارة.
<!--
<!--<!--
شكل(2): يوضح النموذج البنائي للماء السائل, عن : Bernal 1965
<!--
<!--<!--
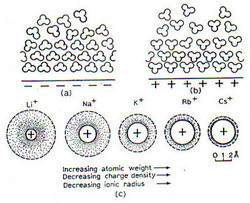
كذلك تتكون الروابط الهيدروجينية بين جزيئات الماء و الجسيمات أو الأسطح المشحونة الأخرى, فعلى الأسطح المشحونة تترتب طبقات من جزيئات الماء شكل(3) a,b . ويتوقف سمك هذه الطبقات على كثافة الشحنة على السطح . فعند ذوبان الأملاح غير العضوية في الماء تتحلل إلى أيونات سالبة و أخرى موجبة , يحاط كل أيون بطبقة من جزيئات الماء المرتبة, وفي حقيقة الأمر ونظراً لوجود هذا الغلاف المائي تظل هذه الأيونات منفصلة في المحلول المائي. ويتوقف سمك غلاف الماء على كثافة الشحنة الكهربائية على أيون ما,حيث تكون سميكة على الأيونات الصغيرة مقارنة بمثيلتها على الأيونات الكبيرة التي تحمل نفس الشحنة الكهربائية,شكل(3) c .
كما يكون الماء روابط هيدروجينية مع الجزيئات العضوية وخاصة تلك التي تحتوي على مجموعات الكربونيل (>C=O) و الهيدروكسيل (-OH) و الأمينو (-NH2) , ويكون سمك الغلاف المائي كبير نظراً لوجود هذه المجموعات في الكثير من الجزيئات الهامة مثل البروتينات , الكربوهيدرات و الأحماض النووية التي تحمل روابط لربط جزيئات الماء بها.
<!--
<!--<!--<!--<!--<!--
تحلل جزيء الماء :
يتحلل جزيء الماء إلى أيونات الهيدرونيوم و أيونات الهيدروكسيل كالآتي:
2H2O H3O + + OH. -
و أيون الهيدروجين (H3O+) عبارة عن (H+ +H2O) والذي عادة ما يمثل بالرمز H+ ويطلق عليه أيون الهيدروجين. ومن ثم فإنه عادة ما يعبر عن تحلل جزيء الماء كالتالي:
H2O H+ + OH. -
<!--
<!--<!--
شكل(3): يبين ترتيب جزيئات الماء على الأسطح المشحونة – a,b – و الحجم النسبي لكتيونات المعادن c- ,تمثل المنطقة المظللة سمك غلاف الماء حول كل أيون.
<!--
<!--<!--
وعند نقطة الاتزان تظل تركيزات أيونات الهيدروجين و الهيدروكسيل – في الماء النقي – ثابتة وقيمتها حوالي 10- 14 جرام – أيون / لتر( جرام واحد من أيونات الهيدروجين في 10 14 لترات ماء). ونظراً لأن العدد الكلي لأيونات الهيدروجين مساوً تماماً لعدد أيونات الهيدروكسيل ,فإن تركيز كل منهم هو 10 – 7 / لتر. ولقد عرف أن قيمة الجهد الهيدروجيني pH للماء النقي يساوي 7, ومن ثم فقد عرف الجهد الهيدروجيني أو قيمة pH بأنها اللوغاريتم السالب لتركيز أيونات الهيدروجين (pH= - log [H+] ) . وتتأثر قيمة اﻟ pH في أي محلول بوجود المواد الذائبة به , فالمحلول الذي يحتوي على تركيز أيون الهيدروجين أعلى من 10 – 7 جرام- أيون لكل لتر (pH>7) يكون حمضيا , في حين إذا كانت القيمة (pH< 7) فإنها تعني أن المحلول قلوي.
النظائر المشعة في الماء :
أفترض منذ زمان مضى أن الماء يتكون من جزيئات تحتوي على هيدروجين عادي (1H) و أوكسجين (16O) التي أوزانهم الذرية هي 1 و 16 على التوالي. إلا أنه في حقيقة الأمر وجد أن الماء الطبيعي يحتوي على نظائر مشعة مثل الديوتيريوم 2H و التريتيوم 3H أما نظائر الأوكسجين فهي 17O و 18O , إلا أن هذه النظائر تتواجد بنسبة ضئيلة جداً فنسبة وجود 1H : 2H هي 6500:1 . وتجدر ملاحظة أن التريتيوم هو النظير الوحيد الذي له نشاط إشعاعي , والذي يعتقد من أنه تكون من تفاعل الأشعة الكونية و فترة نصف الحياة له هي 12.5 سنة.
<!--
<!--<!--
المراجع :
1 – إبراهيم , عاطف محمد – أشجار الفاكهة , أساسيات إنتاجها – 1998 – منشأة المعارف , الإسكندرية , مصر .
2 – إبراهيم , عاطف محمد – النباتات و الماء – المجلة الكيميائية الكويتية – 2004 – 20: 24, العدد 56.
<!--
<!--<!--
3Sutcliffe J.F.1975 .Plants and water .The English Language Book Society and Edward Arnold (Publishers) Ltd.
4Bernal J.D.1965 . Society for Experimental Biology Symposia, 19,17.
<!--
<!--<!--.


