|
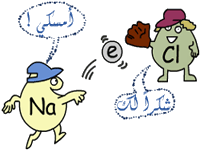
وبعد أن يصبحا أيونين مختلفين في الشحنة يتجاذبان برابطة أيونية ، وتصبح صيغة المركب الأيوني الناتج من اتحادهما هي : NaCl
لاحظ أن مجموع الشحنات في المركب الناتج = صفر .
الرابطة الأيونية Ionic bond
خصائص المركبات والمواد الأيونية
4. المواد الأيونية غير موصلة للتيار الكهربائي في حالة الصلابة . لماذا ؟
لا توصل المواد الأيونية التيار الكهربائي في حالة الصلابة لأن أيوناتها مقيدة برابطة أيونية قوية .
5. تصبح المود الأيونية موصلة للتيار عند إذابتها في الماء أو صهرها بالحرارة . لماذا ؟
تصبح المواد الأيونية موصلة للتيار الكهربائي بعد صهرها أو إذابتها في الماء لأن أيوناتها تصبح حرة الحركة فتوصل التيار .
6. درجات انصهارها عالية . لماذا ؟
يعود ارتفاع درجات انصهار المواد الأيونية لقوة الربطة الأيونية ، لذلك نضطر أحياناً عند محاولة صهرها إلى إضافة مواد تعمل على تخفيض درجة إنصهارها .
مثال :
يضاف القليل من كلوريد الكالسيوم إلى كلوريد الصوديوم لتقليل درجة انصهار الأخير .
الرابطة الأيونية Ionic bond
خصائص المركبات والمواد الأيونية
1. المواد الأيونية مواد صلبة في الظروف الطبيعية .
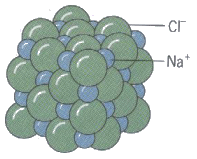
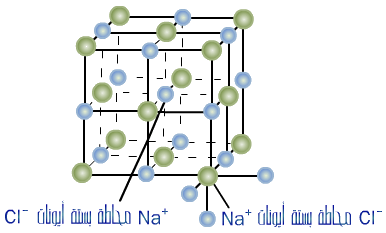
2. توجد المركبات الأيونية على شكل بلورات نسبة الأيونات فيها ثابتة .
مثال :
يوجد ملح كلوريد الصوديوم على شكل بلورة مكعبة تكون نسبة أيونات الصوديوم إلى أيونات الكلور 1 : 1 .
3. المواد الأيونية هشة . لماذا ؟
تترتب أيونات المواد الأيونية على شكل صفوف من الأيونات الموجبة والسالبة ، وعند تعريض المركب الأيوني للطرق تنزاح الطبقات جانبياً فتتحول قوى التجاذب بين الشحنات المختلفة إلى قوى تنافر بين الشحنات المتماثلة .
الرابطة الأيونية Ionic bond
سؤال :
|
إذا علمت أن العدد الذري للمغنيسيوم = 12 وللفلور = 9 وللنيون = 10 فأجب عن الأسئلة التالية :
1. ما عدد الإلكترونات التي يميل المغنيسيوم لفقدها ؟ لماذا ؟ ما الشحنة التي يحملها الأيون ؟
2. ما عدد الإلكترونات التي تميل ذرة الفلور لكسبها ؟ لماذا ؟ ما الشحنة التي يحملها الأيون ؟
3. ما عدد أيونات الفلور التي يمكن أن تتحد مع أيون واحد من المغنيسيوم ؟
4. ما صيغة المركب الناتج من اتحادهما ؟
5. كم يبلغ مجموع الشحنات في المركب الناتج ؟
6. ما نوع الرابطة التي نشأت بينهما ؟
|
سؤال :
|
إذا علمت أن العدد الذري للكالسيوم = 20 وللكبريت = 16 وللفسفور = 15 والبوتاسيوم = 19 فأجب عن الأسئلة التالية :
1.ا شحنة الأيون الثابت لكل من العناصر المذكورة ؟
2. ما صيغة المركب الناتج من اتحاد أيون الكالسيوم مع أيون الكبريت ؟
3. ما صيغة المركب الناتج من اتحاد أيون البوتاسيوم مع أيون الفسفور ؟
4. ما نوع الرابطة التي تنشأ بين أيونات المركبين الناتجين ؟
|
|
 الرابطة الأيونية
الرابطة الأيونية 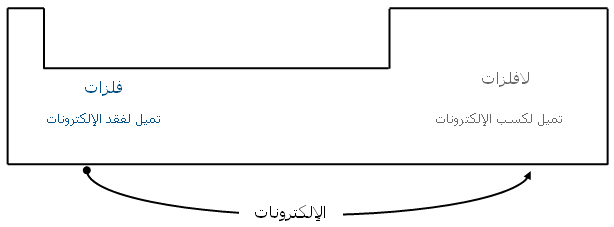







ساحة النقاش