الذرات والجزيئات
أسماء ورموز العناصر
أول من فكر في استخدام رموز للعناصر لتسهيل دراستها هو العالم الإنجليزي (دالتون 1766-1844م) ، فالرموز هي بمثابة الحروف الهجائية المكونة للغة الكيمياء ، ودالتون قد وضع رموز تشكيلية للعناصر ولكن العالم السويدي (برزيليوس 1779-1848م) قام بإبدال رموز دالتون بالرموز الحالية التي تتكون من الحروف الإنجليزية وذلك لتسهيل حفظها
: ولإشتقاق الرموز قواعد وهي
اتفق على أخذ الحرف الأول من الاسم الإنجليزي للعنصر على أن يكتب بشكل كبير كالتالي
|
رمزه |
اسم العنصر |
|
|
بالإنجليزية |
بالعربية |
|
|
H |
Hydrogen |
هيدروجين |
|
B |
Boron |
بورون |
|
O |
Oxygen |
أكسجين |
|
P |
Phosphorus |
فسفور |
|
C |
Carbon |
كربون |
|
I |
Iodine |
يود |
|
U |
Uranium |
يورانيوم |
إذا اشترك أكثر من عنصر في الحرف الأول يكون رمز العنصر الذي اكتشف أولاً مكوناً من الحرف الأول أما العنصر الآخر فيتكون رمزه من حرفين الأول كبير والثاني صغير
|
رمزه |
اسم العنصر |
|
|
بالإنجليزية |
بالعربية |
|
|
He |
Helium |
هيليوم |
|
Be |
Beryllium |
بريليوم |
|
Ca |
Calcium |
كالسيوم |
|
Si |
Silicon |
سيليكون |
|
Cl |
Chlorine |
كلور |
|
Cr |
Chromium |
كروم |
|
Cd |
Cadmium |
كادميوم |
|
Pt |
Platinum |
بلاتين |
ترجع بعض رموز العناصر إلى الاسم اللاتيني للعنصر
|
رمزه |
اسم العنصر |
||
|
باللاتينية |
بالإنجليزية |
بالعربية |
|
|
Na |
Natrium |
Sodium |
صوديوم |
|
K |
Kalium |
Potassium |
بوتاسيوم |
|
Cu |
Cuprum |
Copper |
نحاس |
|
Fe |
Ferrum |
Iron |
حديد |
|
Au |
Aurum |
Gold |
ذهب |
|
Ag |
Argentum |
Silver |
فضة |
|
Hg |
Hydrargyrum |
Mercury |
زئبق |
|
Pb |
Plumbum |
Lead |
رصاص |
توجد رموز بعض العناصر المنسوبة لأسماء مكتشفيها من العلماء
|
رمزه |
اسم العنصر |
العالم المكتشف |
|
|
بالإنجليزية |
بالعربية |
||
|
Cm |
Curium |
كوريوم |
مدام كوري |
|
Es |
Einsteinium |
إينشتانيوم |
ألبرت إنشتاين |
|
No |
Nobelium |
نوبليوم |
الفريد نوبل |
|
Md |
Mendelevium |
ماندليفيوم |
مندليف |
|
Fm |
Fermium |
فريميوم |
انريكوفيرمي |
هناك رموز لبعض العناصر المشتقة أسماؤها من مكان اكتشافها
|
رمزه |
اسم العنصر |
مكان الإكتشاف |
|
|
بالإنجليزية |
بالعربية |
||
|
Cf |
Californium |
كاليفورنيوم |
جامعة كاليفورنيا |
|
Po |
Pollonium |
بولونيوم |
بولندا |
|
Bk |
Berkelium |
بريكليوم |
|
|
Am |
Amerecium |
أمريكيوم |
أمريكا |
توجد رموز بعض العناصر المنسوب اسمها لاسم أحد الكواكب السيارة
|
رمزه |
اسم العنصر |
اسم الكوكب |
|
|
بالإنجليزية |
بالعربية |
||
|
U |
Uranium |
يورانيوم |
اورانوس |
|
Pu |
Plutonium |
بلوتونيوم |
بلوتو |
|
Np |
Neptunium |
نبتونيوم |
نبتون |
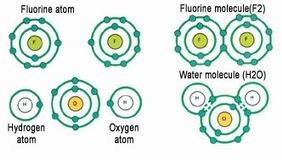
مدلول الرمز الكيميائي للعنصر
، فماذا تعني هذه الأرقام؟ H2O عندما تشاهد جزيئاً كيميائياً فإنك ترى بأنه ليس مكون من رموز العناصر فقط بل مع أرقام ، فمثلاً جزيء الماء
لكي تتعرف على معنى هذه الأرقام انظر إلى الجدول التالي
|
يدل على |
الرمز مع الرقم |
|
ذرة واحدة من الأكسجين |
O |
|
2O |
|
|
O2 |
|
|
3O2 |
|
|
وهكذا مع باقي العناصر |
|
وكما ترى أن جزيء الماء يتكون H2O والآن لنفسر معنى جزيء الماء ، فكما عرفت أن جزيء الماء يكتب هكذا
من عنصرا الهيدروجين والأكسجين مرتبطان مع بعضهما ليكونا جزيء الماء
ولكن توجد أرقام وقد عرفت معناها قبل قليل ، ولكي تستطيع معرفة مدلول الأرقام هذه بسهولة عليك تقسيمها كالآتي
H2
O
هو جزيء يتكون من ذرتين هيدروجين H2 الآن أصبحت سهلة عليك لكي تعرف مدلول الأرقام ، فكما ترى أن الهيدروجين
هو ذرة واحدة من الأكسجين O وأن الأكسجين
فنستنتج أن جزيء الماء يتكون من ذرتين هيدروجين متحدتين مع بعضهما وذرة أكسجين
|
تـــمـــريـــن 1 |
|
3H ماهو مدلول عنصر الهيدروجين الذي رمزه الكيميائي هو : الـــــــحــــــل |
|
تـــمـــريـــن 3 |
|
Al2(SO4)3 ماهو مدلول مركب كبريتات الألمنيوم الذي رمزه الكيميائي هو : الـــــــحــــــل فكما ترى أن لدينا جزيء ألمنيوم يتكون من ذرتين وكذلك لدينا جزيء كبريت يتكون من ثلاث ذرات وأيضاً لدينا جزيء أكسجين يتكون من 12 ذرة ، وهذه الجزيئات الثلاثة متحدة لتكون لدينا مركب كبريتات الألمنيوم |
|
تـــمـــريـــن 4 |
|
2HCl ماهو مدلول مركب حمض الهيدروكلوريك المخفف الذي رمزه الكيميائي هو : الـــــــحــــــل فكما ترى أن لدينا جزيء هيدروجين يتكون من ذرتين وهذا الجزيء متحد مع جزيء كلور يتكون من ذرتين ، ليتم تشكيل حمض الهيدروكلوريك المخفف |
الـــتـــكـــافـــؤ
لقد مرت علينا قبل قليل مسميات جديدة عليك والتي قلنا عنها "مركبات" فهل تعرف ماهي المركبات؟ إن المركبات كما لاحظت قبل قليل إنها تتكون من أكثر من عنصر ، فمثلاً الماء ،فهو يعتبر مركباً ، لماذا؟ لأنه يتكون من أكثر من عنصر فهو يتكون من الأكسجين والهيدروجين ، كل هذه معلومات عادية فنحن لانريد إلا أن نعطيك فكرة عن المركبات ، ولكننا هنا نريدك أن تعرف مثلاً لماذا نحن كتبنا رمز مركب الماء بهذا الشكل لماذا لم نكتب الهيدروجين أولاً ثم الأكسجين ثم العدد 2 ، وهنا يأتي دور التكافؤ لأنه هو الذي يقوم بهذه المهمة - مهمة تركيب رموز المركبات بشكل صحيح - وبما اننا وصلنا إلى التكافؤ فعلينا تعريفه
التكافؤ هو : قدرة العنصر على الإتحاد بذرات العناصر الأخرى ويوجد تعريف آخر وهو على ضوء النظرية الإلكترونية : عدد الإلكترونات التي تفقدها أو تكتسبها أو تساهم بها الذرة ويقدر التكافؤ بعدد ذرات الهيدروجين التي تتحد مع ذرة واحدة من العنصر أو تحل محلها ولكي نوضح لك الفكرة بشكل عام سوف نأخذ مثلاً على ذلك وهو الماء
ولكن هذه الطريقه تغيرت بعد اكتشاف تركيب الذرة ومعرفة مكوناتها ، فتغير هذا المفهوم إلى مفهوم آخر وهو الذي يعتمد على النظرية الإلكترونية ، فالتفاعلات الكيميائية تكون مصحوبة بتغير في التركيب الإلكتروني لذرات المواد المتفاعلة ، ويكون ذلك إما بفقدان أو اكتساب إلكترونات أو المشاركة بعدد من الإلكترونات الخارجية وذلك لوصول الذرات إلى حالة من الاستقرار والثبات المشابه لأقرب غاز نبيل لها في الجدول الدوري للعناصر (الجدول الدوري سوف تعرفه لاحقاً إن شاء الله) ، ولكي تقترب الفكرة من ذهنك وتفهمها عليك بقراءة المثال التالي
وهنا وضعت جدولاً بقيم تكافؤ بعض العناصر
|
تكافؤه |
رمزه |
اسم العنصر |
|
3 |
Al |
ألومنيوم |
|
4 |
Si |
سيليكون |
|
2,1 |
Cu |
نحاس |
|
2,1 |
Hg |
زئبق |
|
3,2 |
Fe |
حديد |
|
3,2 |
Co |
margin-bottom: .0001pt; text-align: center; line-height: normal; direction: ltr; unicode-bidi: embed; mso-element: frame; mso-element-frame-hspace: 2.25pt; mso-element- نشرت فى 30 سبتمبر 2011
بواسطة Gharibadar
مجاز تقاني بالهنسة المدنية
مجاز تقاني بالهنسة المدنية طالب بكلية التجارة والاقتصاد مدرس (رياضيات - فيزياء- كيمياء) لمرحلة التعليم الاساسي »
أقسام الموقعابحثتسجيل الدخولعدد زيارات الموقع
31,911
|



ساحة النقاش