
التبلور (أو البَلْوَرَة) عبارة عن عملية تشكيل (طبيعية كانت أم اصطناعية) للبلورات الصلبة من المحلول.
تعد عملية التبلور أيضاً من تقنيات الفصل في الأوساط الصلبة-السائلة، حيث تحدث عملية انتقال لجزيئات للمادة من الحالة السائلة إلى الحالة الصلبة.
تعتمد عملية التبلور على ضبط درجة حرارة الوسط وضبط الضغطوإعطاء النظام الوقت الكافي الذي يسمح بتكون البلورات الكبيرة.
- يحتاج تبلور الألماس ضغوطا عالية جدا (60.000 ضغط جوي) ودرجة حرارة عالية ولهذا يندر وجوده، ويحتاج فوق ذلك إلى وقت طويل يعد بآلاف السنين لكي ينتج من الجرافيت بلورات ألماس كبيرة.
- نلاحظ تبلور الجليد طبقا للنظام البلوري السداسي، وهذا يرجع إلى شكل جزيئ الماء H-O-H المثلثي الشكل، ويشكل زاوية H-O-H قدرها 120 درجة في جميع الأحوال الغازية والسائلة والصلبة.
التبلور في الطبيعة
ونشاهد في الطبيعة ظواهر كثيرة تتضمن عملية التبلور، وفي كثير من الأحيان تكون عصورا جيولوجية طويلة قد مضت حتى تتكون، مثل:
ومن الأشكال المعهودة التي تتبلور خلال وقت قصير :
تطبيقات
تستخدم عملية التبلور في نوعين من التطبيقات لإنتاج " التبلور الصناعي" وهما: أنتاج البلورات ولتنقية المعادن والمركبات.
انتاج البلورات
من وجهة علم المواد والصناعة تدرس وتبتكر طرق لتنمية البلورات : تستخدم طرق تعيين البنية البلورية بواسطة أشعة إكس وكذلك مطيافية الرنين المغناطيسي النووي NMR spectroscopy في الكيمياء المعدنية والكيمياء العضوية لمعرفة الهياكل البلورية لأعداد كبيرة من المركبات المعدنيةوالمركبات العضوية ، ومن ضمنها دراسة بنية الجزيئات العضوية الكبيرة. أمثلة لمنتجات على المستوى الصناعي الكبير:
علاقة التبلور والترموديناميك
تعتمد عملية التبلور على الترموديناميكا وحركة الجزيئات مما يجعل من الصعب التحكم في تلك العملية. وتدخل فيها مسألة نقاوة المادة المتبلورة ، وطريقة خلط المكونات ، وتصميم بوتقة التبلور ، وخطة التبريد ، كل تلك العوامل تؤثر على حجم البلورة المتكونة ، وعدد البلورات ، وشكلها.
ويمكننا تصور عملية التبلور بتخهيل جزيئ في داخل "بلورة مثالية" عندما ترفع درجة حرارتها بواسطة مصدر حراري خارجي. فعند وصول البلورة إلى درجة حرارة معينة (مميزة لمادة البلورة) ، ينق الرباط بين الجزيئ وما حولة فجأة ، ولحظيا يحدث ذلك لجميع الجزيئات في البلورة فتنفصل الجزئيات عن بعضها وتفقد هيكلها البلوري مكونة سائلا (يصبح توزيع مجموع الجزيئات عشوائيا لا شكل داخليا له). وتصف الديناميكا الحرارية تلك العملية بأن تحول المادة الصلبة المتبلورة إلى السيولة بسبب زيادة الإنتروبية S حيث تزيد عشوائية توزيع الجزيئات في النظام ، وتغلبه على الإنثالبية H ، أي قوي الروابط بين الجزيئات.

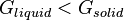
G تسمى طاقة جيبس الحرة وهي في السائل أقل من مقدارها في المادة الصلبة أو البلورة.
تلك العملية تحدث دائما عند ارتفاع درجة الحرارة. كذلك بالنسبة إلى عملية التبريد ، فعد التبريد ووصول درجة الحرارة المميزة للمادة ، فجأة تتشابك الجزيئات وتتخذ شكلها البلوري. بذلك تنخفض الأنتروبية بسبب تبوء الجزيئات أماكن ثابتة منتظمة في البلورة. وهي عندما تترابط فيما بينها فهي تطلق حرارة الارتباط إلى الجو المحيط بها الذي يزيد من عشوائية الذرات والجزيئات في الكون - أي تزيد انتروبية الكون.
ولكن السوائل التي تتصرف بهذه الطريقة عند تبريدها قليلة ، فعلى الرغم منالقانون الثاني للديناميكا الحرارية يحدث التبلور عادة عند درجة حرارة أقل قليلا عن درجة الحرارة المميزة للمادة - عند حالة للسائل تسمي "تبريد فائق". وهذا يعني من وجهة الترموديناميكا أنه من الأسهل هدم البلورة وتفرقة جزيئاتها عن جمعهم وبناء النظام البلوري.
وإنه من الأسهل إذابة بلورة في مذيب عن تكوين بلورة منتظمة من هثل ذلك المحلول. إن تكوين نواة ابتدائية للتبلور وتنمية البلورة يعتمد على التحكم في حركة الجزيئات أكثر من اعتمادة على التحكم في الحركة الحرارية (الترموديناميك).


