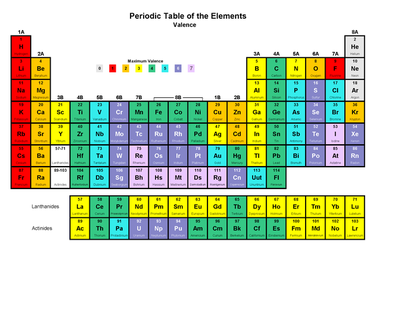

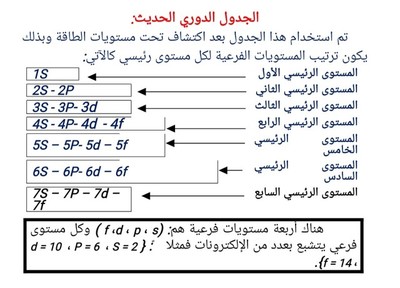
أولاً: فئة العناصر [S]:
موقعها:
المنطقة اليسرى من الجدول الدوري وهي تحتوي على العناصر التي تقع إلكتروناتها الخارجية في المستوى الفرعي [S] وتقع في مجموعتين هما: [ns1] مع [ns2] حيث [n] هو رقم مستوى الطاقة الأخير.
ويشير [n] إلى رقم الدورة فمثلاً عنصر الصوديوم 11Na يكون التوزيع الإلكتروني لـه هو: لذلك يقع العنصر في الدورة الثالثة حيث 3 = n ومجموعته (IA) وعنصر الكالسيوم Ca ويكون تركيبه الإلكتروني: لذلك يقع في الدورة الرابعة حيث n = 4 ويقع في المجموعة ( 2 A ) .
ثانياً: فئة العناصر [P]:
موقعها:
تقع في المنطقة اليمنى من الجدول الدوري حيث تقع العناصر التي تكون الكتروناتها الخارجية في المستوى الفرعي (P) وتشمل المجموعات:
3A np1
4A np2
5A np3
6A np4
7A np5
np6
عناصر الفئتين [P , S] ما عدا الغازات النبيلة تسمى عناصر مثالية.
ثالثاً: فئة العناصر [d]:
موقعها:
وسط الجدول الدوري وتحتوي على عناصر تقع الكتروناتها الخارجية في المستوى الفرعي [d] وتسمى هذه العناصر [عناصر انتقالية] وتقع في ثلاث سلاسل وهي:
[1] السلسلة الانتقالية الأولى :
يتتابع فيها امتلاء المستوى الفرعي [3d] وتشمل عشرة عناصر تبدأ من عنصر الإسكانديوم 21Sc وتنتهي بعنصر الخارصين 30Zn وتقع في الدورة الرابعة حيث n = 4.
[2] السلسلة الانتقالية الثانية :
يتتابع فيها امتلاء المستوى الفرعي [4d] وتشمل عشرة عناصر وتبدأ بعنصر اليوتريوم 39Y وتنتهي بالكادميوم 48Cd وتقع في الدورة الخامسة حيث n = 5.
[3] السلسلة الانتقالية الثالثة :
يتتابع فيها امتلاء المستوى الفرعي [5d] وتشمل عشرة عناصر وتبدأ بعنصر اللانثانيوم 57La وتنتهي بالزئبق 80Hg وتقع في الدورة السادسة حيث n = 6.
رابعاً: فئة العناصر [f]:
وتتابع فيها امتلاء المستوى الفرعي (f) وتتقسم إلى سلسلتين هما :
(أ) سلسلة اللانثانيدات :
يتتابع امتلاء المستوى الفرعي [4f] وتتكون من أربعة عشرة عنصراً. ونلاحظ أن المستوى الأخير (مستوى التكافؤ) لجميع هذه العناصر هو [6S2] وذلك لأن التوزيع الإلكتروني لها ينتهي كما يلي:
أي أن المستويات الثلاثة الأخيرة غير مكتملة.. وبما أن التوزيع الإلكتروني الخارجي لها واحد لذلك فهي شديدة التشابه في الخواص بحيث يصعب فصلها عن بعضها ومن هنا جاءت تسميتها عناصر أرضية نادرة.
علل : تسمى اللانثانيدات بالعناصر الأرضية النادرة ؟
(ب) سلسلة الأكتينيدات :
وفيها يتتابع امتلاء المستوى الفرعي [5f] وهي أيضاً تتكون من أربعة عشرة عنصراً لاحتواء المستوى الفرعي 5f على سبعة أفلاك وكلها عناصر ذات نشاط إشعاعي لعدم استقرار أنويتها وعموماً يطلق على اللانثاتيدات والأكتينيدات معاً (عناصر انتقالية داخلية).
الجدول الدوري أربع فئات:
(1)عناصر مثالية:
عناصر الفئتين P , S ما عدا عناصر المجموعة الصفرية ومن خواصها:
تتميز بامتلاء جميع مستويات الطاقة بالإلكترونات ما عدا مستوى الطاقة الأخير.
يتطابق التركيب الإلكتروني لها مع رقم الدورة والمجموعة والتكافؤ.
تميل إلى الوصول إلى التركيب ns2 / np6 للمستويات الخارجية عن طريق الفقد أو الاكتساب أو المشاركة الإلكترونية.
(2) عناصر انتقالية رئيسية: وهي عناصر الفئة (d) ومن خواصها:
تتميز بأن مستوى الطاقة الأخير وقبل الأخير غير مكتملين.
تتميز بتعدد حالات التأكسد. التوزيع الإلكتروني لها: [].
(3) عناصر انتقالية داخلية: وهي عناصر الفئة( f )ومن خواصها:
مستويات الطاقة الثلاثة الأخيرة غير مكتملة. التوزيع الإلكتروني لسلسلة اللنثانيدات ينتهي بـ: .
التوزيع الإلكتروني لسلسلة الأكتينيدات ينتهي بـ:
(4) عناصر نبيلة:
وهي عناصر الفئة (p) عدا الهيليوم ومن خواصها:
جميع مستويات الطاقة فيها مكتملة.
كلها غازات وتقع في آخر مجموعة بعد السابعة الرئيسية.
التوزيع الإلكتروني لها ينتهي بـ: { np6}.
وصف الجدول الدوري الحديث:
عدد 18 مجموعة رأسية.
عدد الدورات (7) دورات أفقية. القانون الدوري يعتمد على ترتيب العناصر تصاعدياً حسب الزيادة في العدد الذري. يتوافق مع مبدأ البناء التصاعدي أي أن كل عنصر يزيد عن العنصر الذي يسبقه بإلكترون واحد فقط.
تبدأ كل دورة بمليء مستوى طاقة جديد بإلكترون واحد وتنتهي بغاز خامل.
في المجموعة الواحدة نجد أن عناصرها متشابهة في الخواص والتركيب الإلكتروني وكذلك مستوى الطاقة الأخير ولكنها تختلف في عدد الكم الرئيسي.
العنـاصـر الانتقـاليـة
الجدول الدوري مقسم إلى أربعة تكتلات وهي الفئات [f , d , p , s ] . وتم دراسة عناصر الفئة (s , p) سابقا وهي تعرف بالعناصر الأساسية ومجموعاتها تأخذ الحرف (A) . انظر الجدول الدوري.
تتمثل العناصر الانتقالية في التكتلين (الفئتين) f , d .
العنصر الانتقالي :
هو العنصر الذي تكون فيه مدارات المستوى الفرعي d أو f مشغولة بالإلكترونات ولكنها غير ممتلئة امتلاء تام سواء في الحالة الذرية أو في أي حالة أيوناته.
او هو العنصر الذي ينتهي توزيعه الالكتروني بالمدار d او المدار f الممتلئة جزئيا بالإلكترونات
مثال توضيحي
السكانديوم( 21Sc ): عنصر انتقالي لامتلاكه للمستوى الفرعي 3d غير ممتلئ كما هو موضح في توزيعه الإلكتروني: 21Sc [18Ar] 3d1 4S2
ما الغلاف الفرعي غير مكتمل بالإلكترونات لهذه الذرات 26Fe , 30Zn , 80Hg 29 Cuوهل هذه العناصر انتقالية أم لا ولماذا ؟
لتحديد المستوى الفرعي غير مكتمل بالإلكترونات نقوم بالتوزيع الإلكتروني لتلك الذرات كما يلي:
26Fe [18Ar] 3d6 4S2
30Zn [18Ar] 3d10 4S2
80Hg [54Xe] 4f14 5d10 6S2
29Cu [18Ar] 3d10 4S1
نلاحظ من التوزيع الإلكتروني أن ذرة الحديد فقط هي التي تمتلك مستوى فرعي 3d غير مكتمل وبالتالي يعتبر عنصر الحديد عنصر انتقالي ـ أما
ذرة ( 30Zn ،80Hg ) فكل منهما عنصر غير انتقالي (علل) ؟
ج/ لأن المستوى الفرعي (d) مكتمل بالإلكترونات سواء منفردا أو في حالة آيوناته.
بينما نلاحظ أن ذرة النحاس تمتلك مستوى فرعي 3d10ممتلئ بالإلكترونات في الحالة العادية بينما في حالة أيوناته يكون المستوى 3d9أي غير ممتلئ بالالكترونات لذلك فإن النحاس يعتبر عنصر انتقالي .
تقسيم العناصر الانتقالية :
إلى قسمين هما:
(1) عناصر انتقالية رئيسية Main Transition elements .
(2) عناصر انتقالية داخلية Inner Transition elements
أولا : العناصر الانتقالية الرئيسية :
(1) هي عناصر الفئة d وهذه العناصر جميع مستوياتها الرئيسية مكتملة ماعدا المستويين الرئيسيين الأخيرين .
(2) العناصر الانتقالية الرئيسية يتم فيها امتلاء المستوى الفرعي (d) تدريجيا بإلكترون واحد كلما زاد العدد الذري حتى يكتمل المستوى الفرعي بعشرة إلكترونات ومن هذا نجد أن:
أ- العناصر الانتقالية الرئيسية تتكون من عشرة أعمده رأسية (مجموعات ) وتأخذ الحرف (B) وتقع في الدورات الرابعة والخامسة والسادسة.
ب- هذه المجموعات مرتبة من اليسار إلى يمين الجدول كما يلي :
IIIB ( IVB ( VB ( VIB ( VIIB ( VIII ( IB ( IIB
وعناصر هذه المجموعات (B) مختلفة كثيرا في نشاطها عن عناصر المجموعات الأساسية التي تأخذ الحرف (A) ويتضح ذلك من خلال الجدول التالي:
رقم المجموعة
عناصرها والتوزيع الإلكتروني
أهــــم صفــاتـهــــا
IB
نحاس- فضة - ذهب
79Au , 47Ag , 29Cu
(n-1)d10 ns1 (غاز نبيل)
تتميز عناصر هذه المجموعة بخمولها الكيميائي ولذا فهي تستخدم لعمل النقود ـ والحلي وتسمى هذه العناصر بفلزات العملات (علل).
IIB
الخارصين - الكادميوم - الزئبق
80Hg , 48Cd , 30Zn
(n-1)d10 ns2 (غاز نبيل)
تتميز عناصر هذه المجموعة بكيمياء بسيطة حيث أنها تمتلك حالات تأكسد محدودة بالمقارنة ببقية العناصر الانتقالية الأخرى ، فمثلا عنصر الخارصين والكادميوم يظهران في حالة التأكسد(+2) ماعدا الزئبق يوجد في حالة التأكسد : (+2) و (+1)
ШB
(Y) (Sc)
سكانديوم ـ يوتريوم ـ لنثانيوم ـ اكتينيوم
(Ac) , ( La)
(n-1)d1 ns2 (غاز نبيل)
أكثر العناصر الانتقالية نشاطا كيميائيا . حيث أن جهود تأكسدها تتقارب مع جهود تأكسد الفلزات القلوية ( عناصر الإقلاء والاقلاء الأرضية IA , IIA ) . فهي تتفاعل مع الماء بشدة.
2Sc + 6H2O → 2Sc(OH)3+6H2↑
س/ علل عناصر المجموعة الثالثة ШB أكثر العناصر الانتقالية نشاطا كيميائياً .
IVB
تيتانيومTi ـ زركونيوم zr ـ هافتيوم Hf
التوزيع الإلكتروني لعناصر الـمجمــوعــــــة :
(n- 1)d2 ns2 (غاز نبيل)
توجد في الطبيعة بنسبة أعلى من عنصر الرصاص والنحاس ولكن يصعب فصلها من خاماتها ويتطلب ذلك عوامل مختزلة قوية جدا ولذا فلزات المجموعة IVB غالية الثمن .
ملاحظة هامة : عنصر التيتانيوم من العناصر الهامة نظرا لوفرة وجوده في القشرة الأرضية ـ ويتميز بأنه يقاوم التآكل ويحافظ على متانته في درجات الحرارة العالية أكثر من الألومنيوم.
س/ علل : يصعب فصل عناصر المجموعة IVB من خاماتها ؟
VB
الفاناديوم 23V - نيوبيوم Nb - تنتاليوم Ta
(n – 1)d3 ns2 (غاز نبيل)
لها جهود تأكسد عالية ولذا لا تتأثر بالأحماض المعدنية القوية مثل HCl ولا بعوامل مؤكسدة قوية مثل الكلور .
س/ علل : لا تتأثر عناصر المجموعة VB بالعوامل المؤكسدة القوية ؟
VIB
كروم24Cr - موليبيديوم Mo - تنجستن W
(n–1)d5 ns2 (غاز نبيل)
تتميز عناصرها بمقاومتها العالية للتأكل وتقاوم فعل العوامل الجوية بسبب تكون طبقة أكسيد غير مسامية على سطوحها تمنع استمرار الأكسدة
س/ علل : تتميز عناصر المجموعة VIB بأنها تقاوم التآكل بفعل العوامل الجوية ؟
VIIB
المنجنيز Mn - تكنيتيوم Tc - رينيوم Re
(n- 1)d5 ns2 (غاز نبيل)
تتميز عناصر هذه المجموعة بأن المستوى الفرعي nd5 يحتوي على خمسة إلكترونات وهي في حالة نصف إملاء للمستوى الفرعي d- أشهر عناصر هذه المجموعة هو عنصر المنجنيز الذي يعد العنصر الثالث عشر من حيث الوفرة في القشرة الأرضية وهو يمتلك أعداد تأكسد متعددة وهي [ +2 ، +3 ، +4 ، +6 ، +7 ]
VIII
تشتمـــل علـــى تسـع عناصر تشغل الأعمدة رقم 8 ، 9 ،10
قسمت إلى ثلاث ثلاثيات أفقية وسميت كل ثلاثية بأشهر عنصر فيها ولها أهمية صناعية كبيرة مثل ثلاثية الحديد [ Ni , Co , Fe ] ثلاثية البلاديوم [Ru , Rh , Pd]
ثلاثية البلاتين [ Os , Ir , Pt] وتتميز بخمولها الشديد ولذا يصنع منها الحلي والأدوات المختبرية
وفي صناعة الأسنان الطبية .
عناصر المجموعة الثامنة VIII لم تأخذ الحرف (B) بسبب اختلاف خواصها عن خواص مجموعات العناصر الأساسية (A).
التركيب الإلكتروني وحالات التأكسد للعناصر الانتقالية :
قُسمـــت العناصر الانتقالية الرئيسية ( الفئة d ) إلى ثلاث سلاسل على
أساس ... [ الأولى - الثانية - الثالثة ] حيث يتم تدريجيا ملء المستوى الفرعي (d) الواقع تحت الغلاف الخارجي مثلاً.
السلسلـة الأولى الانتقالية :
تقع في الدورة الرابعة ويتم فيها امتلاء المستوى الفرعي 3d تدريجيا وهي تتميز بالتوزيع الإلكتروني التالي: [18Ar] 3d1-10 4S2
ويشذ عن ذلك العنصرين التاليين:
الكروم الذي لـه التوزيع الإلكتروني [18Ar] 3d5 4S1 نتيجة انتقال الإلكترون من 4S إلى 3d حتى يصبح المستويين الفرعين 4S ، 3d نصف ممتلئ بالإلكترونات وبذلك تصبح ذرة الكروم أكثر استقرارا.
النحاس 29Cu الذي لـه التوزيع الإلكتروني 18Ar 3d10 4S1 نتيجة انتقال إلكترون من 4S إلى 3d وتصبح المستوى الفرعي 3d مكتمل بعشرة إلكترونات وتصبح الذرة أكثر استقراراً .
1) تكون الذرة أكثر استقرار عندما يكون المستوى d نصف ممتلئ d5 أو تام الامتلاء d10 أو خالي d5 ما في حالة آيون Sc+3.
2) الكروم والنحاس عناصر انتقالية لأنهما يمتلكان مستوى فرعي (d) غير ممتلئ بالالكترونات في حالة أيوناتهم .
حالات التأكسد للعناصر الانتقالية:
حالة التأكسد:
هي حالة العنصر الايونية بعد أن يفقد عدد من الإلكترونات أو يكتسب عدد من الإلكترونات أثناء تفاعله مع العناصر الأخرى مكونة شحنات موجبة وسالبة.
العناصر الانتقالية تتميز بحالات تأكسد متعددة وأعلى رقم تأكسد يتفق مع رقم المجموعة ما عدا عناصر المجموعة IB .
يوضح التوزيع الإلكتروني لعناصر السلسلة الأولى وحالات تأكسدها
الـعـنـصـــــــر
التركيب الإلكتروني
حالات التأكسد
حالة التأكسد الأكثر شيوعا
السكانديوم 21Sc
[18Ar] 3d1 4S2
+3
+3
تيتانيوم 22Ti
[18Ar] 3d2 4S2
2, 3, 4
+4
فانا ديوم 23V
[18Ar] 3d3 4S2
2,3,4,5
+5
كروم 24Cr
[18Ar] 3d5 4S1
2,3,4,5,6
+3
منجنيز 25Mn
[18Ar] 3d5 4S2
2,3,4,5,6,7
+2 , +4
حديد 26Fe
[18Ar] 3d6 4S2
2,3,4,5,6
+3
كوبلت 27Co
[18Ar] 3d7 4S2
2,3,4,5
+2
نيكل 28Ni
[18Ar] 3d8 4S2
2,3,4,5
+2
نحاس 29Cu
[18Ar] 3d10 4S1
1,2
+2
خارصين 30Zn
[18Ar] 3d10 4S2
2
+2
السلسلـة الانتقالية الثانية :
تقع في الدورة الخامسة ويتم فيها امتلاء المستوى الفرعي 4d تدريجياً بإلكترون واحد كلما زاد العدد الذري وهي تبدأ بعنصر وتنتهي بعنصر الكادميوم وهي تشمل على عشر عناصر تتميز بالتوزيع الإلكتروني التالي:48Cd 4d1-10 5S2 .
السلسلـة الانتقالية الثالثة :
تقع في الدورة السادسة ويتم فيها امتلاء المستوى الفرعي 5d تدريجياً بإلكترون واحد كلما زاد العدد الذري وهي تبدأ بعنصر اللانثان 57La ثم تليه أربعة عشر عنصراً انتقالياً داخل ملئ المستوى الفرعي 4F وتنتهي بعنصر الزئبق وهي تشمل على عشرة عناصر لها التوزيع الإلكتروني التالي: 54Xe 5d1-10 6S2 زينون.
ثانيا : العناصر الانتقالية الداخلية ( سلسلتي اللانثانيدات والاكتنيدات )
وهي عناصر جميع مستوياتها الرئيسية مكتملة ماعدا المستويات الرئيسية الثلاثة الأخيرة ويتم فيها امتلاء المستوى الفرعي 5f , 4f الواقع في مستوى تحت الغلاف الخارجي بمقدار غلافين ولذا سميت بالعناصر الانتقالية الداخلية.
تنقسم العناصر الانتقالية الداخلية إلى سلسلتين هما :
(1) سلسلـة اللانثانيدات Series Lanthanide
هي عناصر يتم فيها امتلاء المستوى الفرعي 4f تدريجياً بزيادة إلكترون كلما زاد العدد الذري ولقد سميت عناصرها اللانثانيدات لأنها تلي عنصر اللانثان الذي تليه عناصر السلسلة. وهي تبدأ بعنصر السيريوم 58Ce توزيعه
هو [54Xe] 4f1 5d1 6S2 وتنتهي بعنصر 71Lu توزيعه هو [54Xe] 4f14 5d1 6S2 .
(2) سلسلة الأكتنيدات Actinide Series
هي عناصر يتم فيها امتلاء المستوى الفرعي 5f تدريجياً بزيادة إلكترون كلما زاد العدد الذري ولقد سميت عناصرها بسلسلة الاكتنيدات لأن خواصها مطابقة إلى حد ما بخواص عنصر الاكتينيوم الذي تليه عناصر السلسلة.
تبدأ عناصر السلسلة بعنصر الثوريوم 90Th توزيعه هو[86Rn] 5f1 6d1 7S2 وتنتهي بعنصر اللورنسيوم 103Lr تــــوزيعـــــه هـــــــو : [86Rn] 5f14 6d1 7S1 .
وضعت عناصر سلسلة اللانثانيدات والاكتنيدات أسفل الجدول الدوري لكي تحافظ على شكل الجدول كذلك لاختلاف خواصها عن خواص العناصر الانتقالية الرئيسية.
الخواص العامة للعناصر الانتقالية:
عناصرها يتم فيها امتلاء المستوى الفرعي d أو f تدريجياً بزيادة إلكترون كلما زاد العدد الذري.
جميعها يتمتع بخواص فلزية (لها بريق معدني / موصلة جيدة للحرارة والكهرباء / معظمها قابلة للسحب والطرق / درجة انصهارها وغليانها عالية).
جميع مستوياتها الرئيسية مكتملة ماعدا المستويين الأخيرين كما في عناصر الفئة(d) أو الثلاثة الأخيرة كما في عناصر الفئة (f).
تمتلك أعداد تأكسد متعددة كما في حالات تأكسد المنجنيز.
أكاسيد فلزات عناصر الانتقال لها تأثير قاعدي يختلف عن أكاسيد الفلزات العادية (عـلـــــل ) لأن الخواص القاعدية والحمضية لعناصر الانتقال تعتمد على أعداد تأكسدها ( حالات تأكسدها ) فكلما زاد عدد التأكسد قلت الخاصية القاعدية وزادت الخاصية الحمضية.
مقارنة بين خواص العناصر الانتقالية والعناصر غير الانتقالية.
الفلـزات العـاديــة
الفلـزات الانتقـاليــة
عناصر أساسية مجموعاتها تأخذ الحرف(A).
جميع مستوياتها الرئيسية مكتملة ما عدا المستوى الأخير.
لها أعداد تأكسد محدودة.
أكاسيدها لها خواص قاعدية واضحة مثل: عناصر فلزات الأقلاء والأقلاء الأرضية.
تنشأ نتيجة الملئ التدريجي للأغلفة S أو P.
عناصر انتقالية مجموعاتها تأخذ الحرف(B).
جميع مستوياتها الرئيسية مكتملة ما عدا المستويين أو الثلاث المستويات الرئيسية الأخيرة.
لها أعداد تأكسد متعددة.
لأكاسيدها خواص قاعدية غير واضحة لأنها تعتمد على أعداد تأكسدها.
تنشأ نتيجة الملئ التدريجي للأغلفة الفرعية d أوf.
الـحـديــد 26Fe
التوزيع الإلكتروني له هو ← [18Ar] 3d6 4S2
سوف نكتفي بدراسة إحدى عناصر الانتقال الأكثر شيوعاً وأهمية صناعته وهو عنصر الحديد.
يعتبر الحديد أكثر الفلزات الانتقالية استعمالاً للأسباب الآتية:
وفرة وجوده في القشرة الأرضية.
سهولة استخلاصه من خاماته.
الحديد النقي يمكن العمل منه أنواع مختلفة من الحديد مثل [ الحديد الصلب / الزهر / الحديد المطاوع / سبائك الحديد ].
خـامــات الحـديــــد:
نظراً لأن الحديد عنصر نشط - نوعاً ما- فهو لا يوجد في الطبيعة منفرداً ولكن يوجد على هيئة مركبات أهمها أكاسيد الحديد المختلفة وفيها يمتلك الحديد حالتي التأكسد ( +2 ، +3 ).
مثـــال :
عند تسخين أكسيد الحديد (II) ينحل إلى حديد وأكسيد حديد (III) طبقاً للمعادلة الآتية :
أهـم خـامــات الحـديــــد : يوضحها الجدول الآتي:
اسم الخام
الرمز الكيميائي
الاسم الكيميائي
لونـه
نسبة الحديد فيه
الهيماتيت
Fe2O3
أكسيد الحديد (III) اللامائي
أحمر داكن
45 - 50%
االماجنيتايت
Fe3O4
أكسيد الحديد المغناطيسي
أسود
40 - 70%
الليمونايت
Fe2O3. nH2O
أكسيد الحديد (III) المائي
أصفر
57.14%
السدريت
FeCO3
أكسيد الحديد (III)
اسود
25-50%
11
1) أكسيد الحديد المغناطيسي Fe3O4 عبارة عن خليط من أكسيد الحديد (II) وأكسيد الحديد (III) ولذا للحديد في أكسيد الحديد المغناطيسي حالتين تأكسد مختلفتين (+2،+3 Fe3O4).
2) (علل)يعتبر أكسيد الحديد المغناطيسي Fe3O4 من أهم خامات الحديد؟
لأنه من الممكن فصله بسهولة من الصخور المخلطة معه بواسطة مغناطيس قوي نظرا لاحتوائه على نسبة كبيرة من الحديد.
3) (علل)استخلاص الحديد من خام الهيماتايت Fe2O3 يعد اقتصاديا؟.
ويرجع ذلك لسهولة اختزال خام الهيماتيت.
4) يعرف أكسيد الحديد المائي ( المميأ ) بالصدأ Rust.
5) هناك خامات أخرى للحديد أقل أهمية مثل السيدريت FeCO3 نظراً لأن نسبة الحديد فيها قليلة.
استخلاص الحديد (تعدين الحديد) Extraction of Iron
المقصود باستخلاص الحديد (التعدين) هو الحصول على الحديد في صورته النقية والتي يمكن التعامل معها علميا.
طريقة استخلاص الحديد من خاماته:
يستخلص الحديد من خاماته عن طريق عملية اختزال هذه الخامات بواسطة عوامل مختزلة قوية بحيث تكون هذه العوامل المختزلة رخيصة الثمن (علـــل) .
حتى نستطيع أن نحصل على كميات كبيرة من الحديد.
أهم المواد المختزلة والأقل تكلفة هو الكربون (فحم الكوك).
خطوات استخلاص الحديد من خام الهيماتيت بواسطة الفرن العالي ( اللافح)



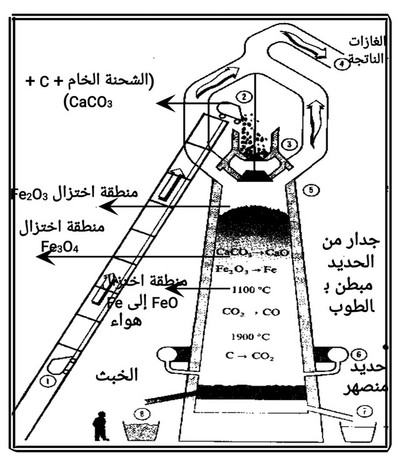
1) يضاف إلى الفرن من خلال الفتحة العلوية الشحنة وهي عبارة عن (خام الحديد + فحم الكوك + الحجر الجيري).
2) يدفع إلى داخل الفرن هواء ساخن مضغوط أو أكسجين نقي وتحدث التفاعلات الآتية التي توضح دور فحم الكوك.
أ - يتأكسد الكربون بالهواء الساخن إلى ثاني أكسيد الكربون وتنطلق حرارة (تفاعل طارده) تؤدي إلى رفع درجة حرارة الفرن من 800م5 إلى 1900م5.
ΔH = -394 KJ CO2 C + O2
ب- يُختزل ثاني أكسيد الكربون بواسطة الكربون إلى أول أكسيد الكربون (عامل الاختزال الفعال) في تفاعل ماص للحرارة .
CO2 + C 2CO2 ΔH = +174Kj
3) تحدث عملية اختزال خام الحديد Fe2O3 بواسطة CO (عامل الاختزال الفعال) في سلسلة من الخطوات.
أ) عند المنطقة العليا يتم اختزال Fe2O3 حسب المعادلة الآتية:
3Fe2O3 + CO 2Fe3O4 + CO2
ب) عند المنطقة الوسطى من الفرن يتم اختزال Fe3O4 إلى FeO حسب المعادلة الآتية:
Fe3O4 + CO 3FeO + CO2
جـ) يتم اختزال FeO أسفل المنطقة الوسطى إلى Fe حسب المعادلة الآتية:
FeO + CO Fe + CO2
دور الحجر الجيري في استخلاص الحديد من خام Fe2O3
1) للحجر الجيري دور هام في التخلص من الشوائب حيث يتفكك بالحرارة إلى أكسيد الكالسيوم وثاني أكسيد الكربون طبقاً للمعادلة الآتية:
CaCO3 CaO + CO2
2) يتفاعل أكسيد الكالسيوم الناتج وهو أكسيد قاعدي مع أكاسيد الشوائب الحمضية مثل [ P2O5 , SiO2 ] ، أو الأكاسيد الأمفوتيرية مثل [ Al2O3] لتكوين ما يسمى بالخبث Slage طبقا للمعادلات الآتية:
CaO + SiO2 CaSiO3
سليكات الكالسيوم
3CaO + P2O5 Ca3 (PO4)2
الخبث فوسفات الكالسيوم
CaO + Al2O3 Ca ( AlO2)2
الومنتات الكالسيوم
ويتجمع الخبث في قاع الفرن طافياً فوق سطح الحديد المصهر لأن كثافته أقل من كثافة الحديد ويخرج الخبث من فتحات خاصة أعلى فتحات خروج مصهور الحديد.
1) الحديد الناتج من الفرن العالي يحتوي على 95% حديد و 4% كربون والباقي بعض الشوائب مثل السليكون، المنجنيز، الفوسفور، والكبريت.
2) الخبث الناتج من الفرن العالي يستخدم في صناعة الإسمنت ورصف الطرق .
(1) الخواص الفيزيائية للحديد:
الحديد النقي في حالته الصلبة فلز فضي اللون مائل للسواد.
قابل للطرق والسحب.
موصل جيد للحرارة والكهرباء.
كثافته عند 20o م تساوي 7.844 جم/سم3 ودرجة انصهاره 1535م5 وغليانه 2750م5.
عند إنصهاره يزداد حجمه بمقدار 4.4 %
(2) الخواص الكيميائية للحديد:
1) تأثير الهواء على الحديد:
أ)الهواء الجاف:
لا يتأثر الحديد بالهواء الجاف في درجات الحرارة العادية نظراً لأن الحديد أقل الفلزات النشطة نشاطاً كيميائياً.
ب)الهواء الرطب:
يتأثر الحديد بالهواء الرطب مكوناً صدأ الحديد
4Fe + 2H2O + 3O2 2(Fe2O3 . H2O) صدأ الحديد
جـ)الهواء الساخن :
يتأكسد الحديد إذا سخن في الهواء مكوناً أكسيد
الحديد المغناطيسي. Fe3O4 3Fe + 2O2
2) تأثير اللافلزات:
أ) مع الكبريت (عامل مختزل):
يتحد الكبريت مع الحديد بالتسخين مكوناً كبريتيد الحديد (II) FeS Fe + S
ب) مع الكلور:
إمرار غاز الكلور على حديد ساخن لدرجة الاحمرار يتكون كلوريد الحديد III (علل)؟
ج/لأن غاز الكلور عامل مؤكسد يؤكسد الحديد (II) إلى الحديد (III) وفقاً للمعادلة الآتية. 2FeCl3 2Fe + 3Cl2
3) تأثير الماء على الحديد:
نظرا لأن الحديد يقع في السلسلة الكهروكيميائية قبل الهيدروجين فهو يحل محل الهيدروجين في مركباته مثل (الماء - الأحماض). أي أن الحديد يختزل الهيدروجين من الماء والأحماض ولذا يعتبر الحديد من المواد المختزلة.
علل الحديد من المواد المختزلة ؟
مثـــال :
تفاعل الحديد الساخن مع بخار الماء ومكونا أكسيد الحديد المغناطيسي + هيدروجين.
3Fe + 4H2O حـرارة Fe3O4 + 4H2 ↑
4) تأثير الأحماض على الحديد:
أ) مع حمض الهيدروكلوريك:
يتفاعل الحديد مع حمض الهيدروكلوريك المخفف أو المركز ويعطي كلوريد الحديد (II) وليس كلوريد حديد (III) (علل).
Fe + 2HCl مخفف أو مركز FeCl2 + H2 ↑
يرجع ذلك لأن غاز الهيدروجين الناتج يختزل كلوريد الحديد (III) إلى كلوريد الحديد (II).
ب) مع حمض الكبريتيك:
يتفاعل الحديد مع حمض الكبريتيك المخفف ويعطي كبريتات الحديد (II) ولا يعطي كبريتات الحديد (III) (علل)
Fe + H2SO2 (dill) FeSO4 + H2 ↑
لا يتفاعل الحديد مع حمض الكبريتيك المركز لتكوين طبقة لزجة وغير منفذه من أكسيد الحديد المغناطيسي التي تحيط بالحديد وتمنع استمرار تفاعله ولكن يتفاعل الحديد مع حمض الكبريتيك المركز الساخن (عامل مؤكسد) ويعطي كبريتات الحديد (II) وكبريتات الحديد (III)
3Fe + 8H2SO4 (مركز) FeSO4 + Fe2(SO4)3 + 4SO2 + 8H2
التفسيــــر :
حمض الكبريتيك المركز الساخن عامل مؤكسد يؤكسد الحديد إلى كبريتات الحديد III ويختزل الحمض إلى [ H2O , SO2 ] وغاز ثاني أكسيد الكبريت يختزل بعض كبريتات الحديد (III) إلى كبريتات الحديد II .
لا يتأثر الحديد بحمض النيتريك المركز (علل) ويرجع ذلك لتكوين طبقة لزجة وغير منفذه من أكسيد الحديد المغناطيسي التي لا تذوب في الماء والأحماض وتحيط بفلز الحديد وتمنعه من استمرار التفاعل.
أمــلاح الحـديـد
أمـــلاح الحـديــد II
أمــلاح الـحديــد III
حالة تأكسد الحديد فيها +2.
أقل ثباتاً.
التوزيع الإلكتروني لأيون الحديد Fe+2 هو: [18Ar] 3d6 4S0
أمثلـة :
* كبريتيد الحديد (II) FeS.
* كبريتات الحديد (II) FeSO4.
* كلوريد الحديد (II) FeCl2
1) حالة تأكسد الحديد فيها +3.
2) أكثر ثباتاً لأن المستوى الفرعي 3d في حالة نصف امتلاء.
3) التوزيع الإلكتروني لأيون الحديد Fe+3 هو: [18Ar] 3d5 4S0
أمثلـة :
* كلوريد الحديد (III) FeCl3
* كبريتات الحديد III Fe2(SO4)3
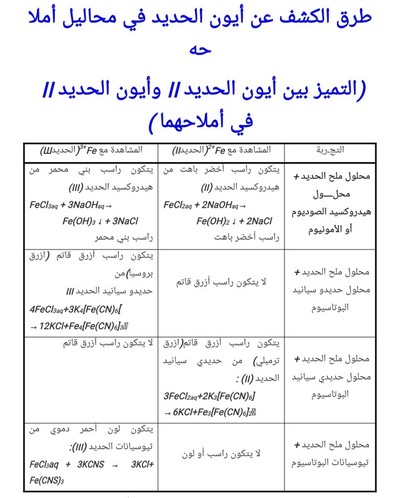
طرق الكشف عن أيون الحديد في محاليل أملاحه
(التميز بين أيون الحديد II وأيون الحديدII في أملاحهما )
| ) |
|
تمت الوحدة بحمد الله


